Международный эндокринологический журнал Том 15, №4, 2019
Вернуться к номеру
Динаміка функціонального стану сім’яників та щитоподібної залози при безплідді в чоловіків із хламідійною інфекцією під впливом патогенетичної терапії
Авторы: Бондаренко В.О. (1), Гончарова О.А. (2), Мінухін А.С. (3), Скорняков Є.І. (1)
1 - ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків, Україна
2 - Харківська медична академія післядипломної освіти, м. Харків, Україна
3 - Національний фармацевтичний університет, м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
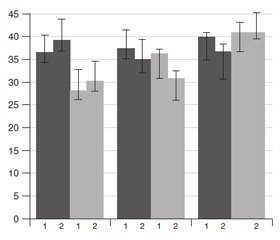
Актуальність. Хламідійна інфекція (ХІ) у безплідних чоловіків асоціюється, з одного боку, з порушенням андроген-естрогенового балансу, а з іншого — з розвитком дистиреозу і зростанням антитіл до тиреоїдної пероксидази (АТ ТПО). Наслідком цих змін може стати розвиток автоімунного тиреоїдиту і на його тлі — субклінічного або маніфестного гіпотиреозу. Мета дослідження: встановити особливості порушень функціонального стану сім’яників і щитоподібної залози (ЩЗ) у чоловіків із безпліддям на тлі ХІ і вплив на них антибактеріальної та антиоксидантної терапії. Матеріали та методи. Обстежено 30 чоловіків віком 23–44 роки, які були в безплідному шлюбі понад рік, у тому числі 15 з хронічним простатитом (ХП) на тлі ХІ (перша група) і 15 з латентною ХІ без запалення урогенітального тракту (друга група). Наявність ХІ визначали методом полімеразної ланцюгової реакції та за рівнем антитіл до хламідій. Параметри спермограм аналізували за критеріями ВООЗ. Лікування включало призначення азитроміцину та імуномодулятора лавомакс протягом 15 і 18 днів. Хворі з ХП протягом 20 днів використовували ректальні протизапальні супозиторії вітапрост. Після курсу антибіотикотерапії призначали комплекс антиоксидантів протягом 45 діб: Цефасель по 100 мкг і вітамін Е по 200 мг на добу. До лікування, через 1 і 2 місяці після лікування у хворих досліджували параметри спермограми, рівні в крові тестостерону (Т), естрадіолу (Е2), тиреотропного гормону, вільного тироксину, АТ ТПО. Контрольну групу становили 10 практично здорових чоловіків аналогічного віку з нормозооспермією (НЗС) і без ХІ. Результати. Після завершення антибіотикотерапії у хворих з ХП на тлі ліквідації запалення простато-везикулярного комплексу (перша група) відзначалося вірогідне зростання відсотка рухомих форм сперміїв. У пацієнтів із латентною ХІ (друга група) через місяць лікування НЗС була відсутня. Після терапії антиоксидантами НЗС була встановлена у 73,3 % пацієнтів у першій групі й у 53,3 % — у другій. Через 2 місяці терапії в першій групі підвищилась частота нормалізації Т в крові й співвідношення Т/Е2. У той же час у другій групі нормалізація величин Т і Т/Е2 була невірогідна. Після завершення лікування змін тиреоїдного статусу не виявлено, але спостерігалося вірогідне зниження рівня АТ ТПО. Висновки. Ліквідація запального процесу в передміхуровій залозі й ХІ як фактора, який його викликав, сприяє активації рухливості сперматозоїдів у безплідних чоловіків. Подальше призначення їм антиоксидантної терапії суттєво підвищує інкреторну функцію яєчок і поліпшує андроген-естрогеновий баланс. Застосування специфічної антибіотикотерапії і короткочасне призначення протягом 15 діб Цефаселю й вітаміну Е при латентній ХІ позитивно не впливає на сперматогенез. Надалі використання антиоксидантів протягом місяця істотно стимулює рухливість сперматозоїдів, але не змінює при цьому рівні Т і Е2. Двохетапна терапія безпліддя при ХІ не впливає на функціональний стан ЩЗ, але сприяє зниженню рівнів АТ ТПО в крові.
Актуальность. Хламидийная инфекция (ХИ) у бесплодных мужчин ассоциируется, с одной стороны, с нарушением андроген-эстрогенового баланса, а с другой — с развитием дистиреоза и ростом антител к тиреоидной пероксидазе (АТ ТПО). Следствием этих изменений может стать развитие аутоиммунного тиреоидита и на его фоне — субклинического или манифестного гипотиреоза. Цель исследования: установить особенности нарушений функционального состояния яичек и щитовидной железы (ЩЖ) у мужчин с бесплодием на фоне ХИ и влияние на них антибактериальной и антиоксидантной терапии. Материалы и методы. Обследовано 30 мужчин в возрасте 23–44 лет, которые находились в бесплодном браке больше года, в том числе 15 с хроническим простатитом (ХП) на фоне ХИ (первая группа) и 15 с латентной ХИ без воспаления урогенитального тракта (вторая группа). Наличие ХИ определяли методом полимеразной цепной реакции и по уровню антител к хламидиям. Параметры спермограммы анализировали по критериям ВОЗ. Лечение включало назначение азитромицина и иммуномодулятора лавомакс в течение 15 и 18 дней. Больные с ХП в течение 20 дней использовали ректальные противовоспалительные суппозитории витапрост. После курса антибиотикотерапии назначали комплекс антиоксидантов в течение 45 суток: Цефасель по 100 мкг и витамин Е по 200 мг в сутки. До лечения, через 1 и 2 месяца после лечения у больных исследовали параметры спермограммы, уровни в крови тестостерона (Т), эстрадиола (Е2), тиреотропного гормона, свободного тироксина, АТ ТПО. Контрольную группу составили 10 практически здоровых мужчин аналогичного возраста с нормозооспермией (НЗС) и без ХИ. Результаты. После завершения антибиотикотерапии у больных с ХП на фоне ликвидации воспаления простато-везикулярного комплекса (первая группа) отмечалось достоверное увеличение процента подвижных форм спермиев. У пациентов с латентной ХИ (вторая группа) через месяц лечения НЗС отсутствовала. После терапии антиоксидантами НЗС была установлена у 73,3 % пациентов в первой группе и у 53,3 % — во второй группе. Через 2 месяца терапии в первой группе достоверно повысилась частота нормализации уровня Т в крови и соотношения Т/Е2. В то же время во второй группе нормализация уровня Т и Т/Е2 была недостоверной. После завершения лечения изменений тиреоидного статуса не выявлено, но имело место достоверное снижение уровня АТ ТПО. Выводы. Ликвидация воспалительного процесса в предстательной железе и ХИ как фактора, который его вызвал, способствует активации подвижности сперматозоидов у бесплодных мужчин. Дальнейшее назначение антиоксидантной терапии способствует существенному усилению инкреторной функции яичек и улучшению андроген-эстрогенового баланса. Применение специфической антибиотикотерапии и кратковременное назначение в течение 15 суток Цефаселя и витамина Е положительно не влияет на сперматогенез. В дальнейшем использование антиоксидантов в течение месяца существенно стимулирует подвижность сперматозоидов, но не меняет при этом уровни Т и Е2. Двухэтапная терапия бесплодия при ХИ не влияет на функциональное состояние ЩЖ, но способствует снижению уровней АТ ТПО в крови.
Background. Chlamydial infection (СI) in infertile men is associated from the one hand, with a violation of the androgen-estrogen balance, and on the other hand, with the development of dysthyroidism and the growth of antibodies to thyroid peroxidase (Ab TPO). These changes may cause the development of autoimmune thyroiditis (AT) and subclinical or manifested hypothyroidism associated with AT. The purpose of the study was to determine the features of impaired functionality of the testes and thyroid gland in infertile men against the background of СI and the effect of antibacterial and antioxidant therapy. Materials and methods. The study involved 30 men aged 23–44 years who had been in an infertile marriage for more than a year, including 15 with chronic prostatitis (CP) on the background of СI (first group) and 15 with latent CI without inflammation of the urogenital tract (second group). The presence of CI was verified by the polymerase chain reaction (PCR) method and the level of antibodies to chlamydia. The parameters of spermogram were analyzed according to WHO criteria. Treatment included the appointment of azithromycin and immunomodulator lavamax for 15 and 18 days. Patients with CP used rectal anti-inflammatory suppositories vitaprost for 20 days. After a course of antibiotic therapy, a complex of antioxidants was prescribed for 45 days: cefasel 100 μg and vitamin E 200 mg per day. Before treatment, after 1 and 2 months after treatment, in the patients the parameters of spermogram, blood levels of testosterone (T), estradiol (E2), thyroid stimulating hormone, free thyroxine, Ab TPO were investigated. The control group consisted of 10 practically healthy men of the corresponding age with normozoospermia (NZS) and without СI. Results. After providing the antibiotic therapy in patients with CP, against the background of the elimination of inflammation of the prostate-vesicular complex (group 1), the percentage of mobile spermatozoids significantly increased. NZS did not follow the treatment one month later in the patients with latent CI (group 2). After therapy with antioxidants NZS was established in 73.3 % of cases in group 1 and 53.3 % in group 2. After 2 months of treatment in group 1, the rate of T level normalization in blood and the ratio of T/E2 increased. At the same time, the normalization of the content of T and T/E2 in the group 2 was not significant. In the post-treatment period, changes in thyroid functionality were not detected, but there was a significant decrease in the level of Ab TPO. Conclusions. Reduction of the inflammatory process in the prostate and СI as the factor causing it promotes the activation of sperm motility in infertile men. The following appointment of antioxidant therapy significantly increases the endocrine function of the testis and improves the androgen-estrogen balance. The use of specific antibiotic therapy and short-term appointment for 15 days of cefasil and vitamin E in latent СI does not have positive effect on spermatogenesis. In the future, the use of antioxidants within one month significantly stimulates the sperm motility, but does not change the level of T and E2. Two-stage therapy of infertility at СI does not impact the thyroid functional state, but contributes to lowering blood levels of Ab TPO.
чоловіче безпліддя; сім’яники; щитоподібна залоза; хламідійна інфекція
мужское бесплодие; яички; щитовидная железа; хламидийная инфекция
male infertility; testis; thyroid gland; chlamydial infection
Вступ
Матеріли та методи
Результати
Обговорення
Висновки
- Gorpynchenko II, Gurzhenko YuN. Use of Tivortin in treatment of excretor-toxic barreness at men. Health of Man. 2014;(51):127-130. (in Russian).
- Lisovyj VM, Arkatov AV, Knigavko OV. Klinichna andrologija: navchal’nyj posibnyk [Clinical andrology: a tutorial]. Kharkiv: KhNMU; 2012. 308 p. (in Ukrainian).
- Pellаti D, Mylonakis I, Bertoloni G, et al. Genital tract infections and infertility. Eur J Obstet Gynecol Reprod Biol. 2008 Sep;140(1):3-11. doi: 10.1016/j.ejogrb.2008.03.009.
- Gurzhenko YuN, Shuliak AV, Spiridonenko AV. The effectiveness of the treatment of patients with urogenital chlamydia, mycoplasmosis and ureoplasmosis with the use of Levolet. Health of Man. 2010;(2):243-246. (in Russian).
- Gimenes F, Souza RP, Bento JC, et al. Male infertility: a public health issue caused by sexually transmitted pathogens. Nat Rev Urol. 2014 Dec;11(12):672-87. doi: 10.1038/nrurol.2014.285.
- Imanov JT. Characteristics parameter of ejaculate during chlamydial infection. Health of Man. 2014;(48):90-102. (in Russian).
- Mavrov GI, Nagorniy AE, Osinska TV. Sexually transmitted infections (STI) in the context of sexual and reproductive health. Health of Man. 2012;(42):149-153. (in Russian).
- Bondarenko VA, Goncharova OA, Minukhin AS, Skornyakov EI. Functional status testes and thyroid gland in men with infertility in presence or absence of chlamidic infection. Problemi Endokrinnoi Patologii. 2018;(64):15-20. doi: 10.218556/j-PEP.2018.2.02. (in Russian).
- Pankiv IV. Effect of vitamin D supplementation on insulin resistance in patients with hypothyroidism. Mìžnarodnij endokrinologìčnij žurnal. 2017;13(6):80-83. doi: 10.22141/2224-0721.13.6.2017.112892.
- Goncharova OA, Karachentsev IuY. Autoimmunnaia tireoidnaia patologiia [Autoimmune thyroid pathology]. Kyiv: Publisher Zaslavsky OYu; 2017. 212 p. (in Russian).
- Spivak JS, Bondarenko VO, Miroshnichenko AV. Dynamics of testes’ functional state of infertile men with autoimmune thyroiditis under the influence of antioxidant-immunocorrective. Journal of Clinical and Experimental Medical Research. 2013;1(2):144-148. (in Ukrainian).
- Wajner SM, Wagner MS, Maia AL. Clinical implications of altered thyroid status in male testicular function. Arq Bras Endocrinol Metabol. 2009 Nov;53(8):976-82.
- Gorpynchenko II, Romanjuk MG. Male infertility: etiology, pathogenesis, diagnosis and modern treatment methods. Health of Man. 2016;1:8-16. doi: 10.30841/2307-5090.1 (56).2016.95374. (in Ukrainian).
- Shcherbakova IuV. Modern aspects of the treatment of urogenital chlamydia. Klinichna immunolohiia. Alerholohiia. Infektolohiia. 2010;(1): 47-51. (in Russian).
- Lytvynec’ JeA, Lesin AI, Kozak OO. Efficiency and safety of complex therapy of patients with chronic prostatitis due to chlamydial infection and infectious associations. Health of Man. 2009;(29):139-140. (in Ukrainian).
- Cooper TG, Noonan E, von Echardstein S, et al. Word Health organization reference values for human semen characteristics. Hum Reprod Update. 2010 May-Jun;16(3):231-45. doi: 10.1093/humupd/dmp048.
- Minukhin AS, Bondarenko VA, Kononenko NN. The possibility of using a complex of phytopreparations, vitamins and trace elements in the treatment of chronic abacterial prostatitis. Science Rise: Medical Science. 2018;(22):14-18. doi: 10.15587/2519-4798.2018.124680. (in Russian).
- Isidori AM, Pozza C, Gianfrilli D, Isidori A. Medical treatment to improve sperm quality. Reprod Biomed Online. 2006 Jun;12(6):704-14.
- Zini A, Al-Hathal N. Antioxidant therapy in male infertility: fact or fiction? Asian J Androl. 2011 May;13(3):374-81. doi: 10.1038/aja.2010.182.
- Pankiv VI, Yuzvenko TYu, Pankiv IV. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problemi Endokrinnoi Patologii. 2019;(2):46-51. doi: 10.21856/j-PEP.2019.2.07.
- Karpenko NA, Bondarenko VA, Kavok NS, Borikov OYu. The maturation of the spermatozoa: events, consequences and possibleways of control. Fiziologichnyi Zhurnal. 2007;53(1):91-103. (in Ukrainian).

/313-1.jpg)
/313-2.jpg)
/314-1.jpg)