Резюме
Рівень глікованого гемоглобіну (HbA1c) свідчить про вміст в організмі кінцевих продуктів посиленого глікозилювання (advanced glycation end products, AGE), однак на практиці потреба у його визначенні недооцінюється. З метою обговорення діагностичного та прогностичного значення HbA1c проведено огляд літератури, проаналізовано результати обстеження 116 хворих на ішемічну хворобу серця з детальним аналізом метаболізму вуглеводів, включаючи проспективне спостереження за ними впродовж 40 місяців. Встановлено, що рівень HbA1c свідчить про вміст AGE, які стимулюють продукцію вільних радикалів та окисну модифікацію протеїнів і ліпідів, зменшують клітинний транспорт, активують запальні цитокіни та хемокіни, викликають імунні реакції та мутації, підвищують активність молекул адгезії та порушують функцію рецепторів. Обговорюється їх роль у патогенезі багатьох захворювань — артеріальної гіпертензії, діабетичних судинних ускладнень, нефропатії, атеросклерозу, хвороби Альцгеймера, деменції, катаракти, передчасного старіння, втрати м’язової маси, поганого загоєння ран та злоякісних пухлин тощо. За власними даними, HbA1c є маркером незадовільного метаболічного контролю впродовж останніх трьох місяців, судинних ускладнень при цукровому діабеті (ЦД), коронарної патології, дисліпідемій, інсулінорезистентності, системного запалення та високої ймовірності виникнення ЦД у найближчі три роки. Цей показник дозволяє диференціювати гостру стресову та хронічну гіперглікемії. Вміст HbA1c слід контролювати не тільки у хворих на ЦД, але й в осіб похилого і старечого віку, курців, пацієнтів з атеросклеротичним ураженням судин та хелікобактерною інфекцією.
Уровень гликированного гемоглобина (HbA1c) свидетельствует о содержании в организме конечных продуктов усиленного гликозилирования (advanced glycation end products, AGE), однако на практике необходимость в его определении недооценивается. С целью обсуждения диагностического и прогностического значения HbA1c проведен обзор литературы, проанализованы результаты обследования 116 больных ишемической болезнью серца с детальным анализом метаболизма углеводов, включая проспективное наблюдение за ними на протяжении 40 месяцев. Установлено, что уровень HbA1c свидетельствует о содержании AGE, которые стимулируют продукцию свободных радикалов и окислительную модификацию белков и липидов, уменьшают клеточный транспорт, активируют воспалительные цитокины и хемокины, вызывают иммунные реакции и мутации, повышают активность молекул адгезии и нарушают функцию рецепторов. Обсуждается их роль в патогенезе многих заболеваний — артериальной гипертензии, диабетических сосудистых осложнений, нефропатии, атеросклероза, болезни Альцгеймера, деменции, катаракты, преждевременного старения, потери мышечной массы, плохого заживления ран и злокачественных опухолей и др. По собственным данным, HbA1c является маркером неудовлетворительного метаболического контроля в течение последних трех месяцев, сосудистых осложнений сахарного диабета, коронарной патологии, дислипидемий, инсулинорезистентности, системного воспаления и высокой вероятности возникновения сахарного диабета в ближайшие три года. Этот показатель позволяет дифференцировать острую стрессовою и хроническую гипергликемии. Содержание HbA1c следует контролировать не только у больных сахарным диабетом, но и у лиц пожилого и старческого возраста, курящих, пациентов с атеросклеротическим поражением сосудов и хеликобактерной инфекцией.
Although the level of glycated hemoglobin (HbA1c) indicates the body content of the advanced glycation end products, its value is underestimated in clinical practice. In order to discuss the diagnostic and prognostic value of HbA1c, we conducted a comprehensive literature review and analyzed the results of own investigation that included clinical examination and laboratory testing of 116 patients with coronary artery disease, with a detailed analysis of carbohydrate metabolism and subsequent follow-up period of up to 40 months. It was found that HbA1c level tends to represent the content of advanced glycation end products, which stimulate free radical production and oxidative modification of multiple proteins and lipids, reduce cellular transport, activate pro-inflammatory cytokines and chemokines, cause immune responses and mutations, increase the activity of adhesion molecules, and cause malfunction of receptors. Nowadays, the role of advanced glycation end products is discussed in the pathophysiology of different diseases, such as arterial hypertension, diabetic vascular complications, nephropathy, atherosclerosis, Alzheimer’s disease, dementia, cataract, premature aging, loss of muscle mass, poor wound healing, malignant tumors, etc. According to our data, HbA1c not only indicates poor metabolic control within the preceding 3 months, but also is a sensitive marker of vascular diabetic complications, atherogenic dyslipidemia, insulin resistance, systemic inflammation, coronary events, and the risk of transformation to diabetes mellitus during the next 3 years. Besides, HbA1c is an effective tool for differentiation of stress hyperglycemia, which frequently occurs in patients with acute cardiovascular events, and chronic hyperglycemia caused by overt or latent glucose dysregulation. Blood HbA1c levels should be monitored not only in diabetic patients but also in elder people, smokers, patients with atherosclerotic arterial diseases, and Helicobacter pylori infection.
Вступ
У 2019 році оприлюднено оновлені Європейські настанови щодо ведення діабету, предіабету та серцево-судинних захворювань (ССЗ), які не стільки окреслили підходи до діагностики цукрового діабету (ЦД), скільки акцентували увагу на визначенні кардіоваскулярного ризику та веденні пацієнтів із супутніми ССЗ. Відповідно до цих рекомендацій, (пре-)діабет діагностують як за глікемічними критеріями (глікемія натще, через дві години після стандартного навантаження глюкозою або випадкова), так і за вмістом у крові глікованого гемоглобіну (HbA1c), рівень якого ≥ 6,5 % є критерієм ЦД [1]. Однак власна практика показує, що сімейні лікарі недостатньо обізнані з потребою визначення і контролю HbA1c [2–4], який не входить до переліку обов’язкових безкоштовних досліджень, хоча і згадується у наказі МОЗ України № 1118 від 21.12.2012 р. «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при ЦД 2-го типу». Це зумовлює потребу обговорення діагностичного та прогностичного значення рівня HbA1c у практиці лікаря загальної практики, що і стало метою цієї роботи.
Матеріали та методи
Пошук за ключовими словами «глікований гемоглобін», «HbA1с», «кінцеві продукти посиленого глікозилювання» (advanced glycation end products, AGE) в базі PubMed та у вітчизняній періодиці включив близько 38 000 посилань, з яких обрано публікації про утворення HbA1c та клінічні аспекти його визначення.
Власне дослідження полягало в обстеженні та спостереженні впродовж 40 місяців 116 пацієнтів (51 жінка, 65 чоловіків, медіана віку — 63 роки) з ішемічною хворобою серця (ІХС). Окрім обстежень за протоколом, визначено HbA1c методом іонообмінної хроматографії (набір HUMAN, Німеччина), проведено стандартний оральний глюкозотолерантний тест, визначено інсулін і С-пептид методом твердофазової ензимної імуносорбції (набори DRG Instrumentals GmbH, Німеччина). Чутливість печінки до інсуліну оцінювали за індексами HOMA та QUIKI, чутливість периферійних тканин — за індексами Gutt, Cederholm і Matsuda; сумарну секрецію інсуліну — за площею під кривою інсуліну (ППК І0–120´) та індексом de Fronzo, ранню — за ППК І0–30´, індексами Wareham і Filips, пізню — за ППК І30–120´ та індексом Stumvoll [5].
Статистичну обробку проводили непараметричними методами (тест Фішера і критерій Манна — Уїтні; коефіцієнт Кендалла τ для кореляцій; кумулятивна частка виживання, F-тест Кокса за методом Каплана — Меєра), за рівень значимості приймали 0,05.
Клінічне дослідження проводилось із дотриманням передбачених у таких випадках заходів безпеки для здоров’я пацієнта, захисту його прав, людської гідності та морально-етичних норм відповідно до принципів Гельсінської декларації прав людини, Конвенції Ради Європи про права людини і біомедицини, відповідних законів України; дозволу комісії із біоетики (протокол № 1 засідання комісії з питань етики при Львівському національному медичному університеті імені Данила Галицького від 24 січня 2019 року).
Результати
Утворення HbA1с — це фізіологічний процес неферментативного приєднання молекул моносахаридів (глюкози, фруктози) до вільних аміногруп протеїнів, який відбувається постійно, повільно та необоротно, але значно пришвидшується за умов високого рівня глюкози. Внаслідок цього виникають гліковані протеїни зі зміненими властивостями, здатні реагувати з іншими білками, утворюючи незворотні зв’язки через карбонілові групи. Отже, утворюються великі нерозчинні агрегати змінених протеїнів, відомі як глікотоксини, або кінцеві продукти посиленого глікозилювання (AGE) [6]. Глікозилюється не лише гемоглобін, а й протеїни нейронів, ендотеліоцитів, колагену, еластину, ферментів, імунопротеїнів. З віком AGE накопичуються у багатьох тканинах. Їх надмірне утворення пов’язують із хворобою Альцгеймера, атеросклерозом та віковою дегенерацією макули, що переважають у старших вікових групах. Окрім старіння, глікозилюванню сприяють куріння, хронічний алкоголізм, ожиріння, хоча внески цих чинників залишаються дискусійними [7–9]. Отже, в умовах хронічної гіперглікемії та дії несприятливих факторів, фізіологічний процес глікозилювання значно пришвидшується та призводить до утворення надміру AGE, які мають пряму ушкоджуючу дію.
Неферментативне глікозилювання колагену шкіри призводить до вкорочення, витончення та втрати його структурованості. Отже, рубці будуть тоншими, а час загоєння ран — довшим [10]. Глікозилювання колагену ІV типу, основного компонента базальної мембрани клубочків нефронів, призводить до зміни її ультраструктури та пропускної здатності з розвитком нефропатії [11].
Дисфункція мембран можлива і в інших клітинах. Зокрема, посилення проникності глюкози всередину еритроцитів, сприяє не тільки утворенню HbA1с, а й виходу аденозинтрифосфатаз, що порушує механічні властивості еритроцитів, послаблює їх еластичність, знижує осмотичну резистентність, посилює адгезію та сприяє утворенню мікротромбів [12]. З-поміж усіх показників загального аналізу крові HbA1с прямо та істотно корелював тільки з шириною розподілу еритроцитів (RDW) — індексом гетерогенності розмірів циркулюючих еритроцитів [12], підвищення якого вказує на порушення еритропоезу та разом з показниками MCV і МСНС використовується для уточнення причини анемії. Цікаво, що дослідження останніх років вказують на кореляції RDW з маркерами запалення та окисного стресу, а також серцевою недостатністю, загальною і серцево-судинною смертністю у хворих на ЦД [13, 14].
Нещодавно з’ясовано, що ймовірним механізмом структурних змін мембрани Бруха та виникнення вікової дегенерації макули є глікозилювання фібронектину [15], багатофункціонального глікопротеїну, що міститься у позаклітинному матриксі та відіграє важливу роль в адгезії, міграції, рості й диференціації клітин і захисних реакціях — гемокоагуляції, загоюванні ран, елімінації стороннього білка тощо. Це один з компонентів первинної матриці епітелізації рани, куди з країв рани мігрують кератиноцити, що сприяє процесу грануляції [16]. В експериментальній тваринній моделі діабету встановлено, що фібронектин відіграє роль ліганда для рецепторів інтегрину, які експресуються на поверхні кератиноцитів. Глікозилювання маскує зв’язувальний сайт і порушує взаємодію з інтегрином [17], що розглядається як один з можливих механізмів поганого загоєння ран у хворих на ЦД.
Глікотоксини стимулюють утворення активних форм кисню, викликаючи окисний стрес, впливають на апоптоз та посилюють експресію генів, залучених у реалізацію хронічних запальних реакцій [2, 6]. Дослідження ролі AGE у патогенезі діабетичних виразок стопи підтвердило їх здатність активувати макрофаги через сигнальний шлях NF-κB. Це викликає експресію макрофагами принаймні 13 прозапальних цитокінів і 10 хемокінів, активацію 11 антиапоптичних та супресію трьох проапоптичних генів, а також зменшує експресію двох рецепторів, необхідних для ефективного фагоцитозу — CD 36 та скавенджер-рецепторів 1-го типу класу B. Як джерело енергії активовані макрофаги використовують винятково глюкозу, внаслідок чого їх метаболічна активність суттєво збільшується. Отже, формується так званий персистуючий запальний фенотип макрофагів, що пояснює повільне завершення запалення і погане загоєння хронічних діабетичних виразок [18].
Внаслідок глікозилювання ліпопротеїнів активується катаболізм ліпопротеїнів високої щільності (ЛПВЩ), що значно зменшує їх концентрацію. Приєднання глюкози змінює структуру аполіпопротеїну В (апоВ) — маркера захвату рецепторами ліпопротеїнів низької щільності (ЛПНЩ). Атерогенність глікозильованих апоВ суттєво вища, як і здатність до окиснення. Утворені глікоокси-ЛПНЩ розпізнаються вже не класичними рецепторами, а так званими рецепторами-сміттярами на макрофагах. Їх захват макрофагами посилюється, але внутрішньоклітинний розпад відбувається повільно. Це стимулює перетворення макрофагів у пінисті клітини, що запускає або прискорює атерогенез, активує агрегацію тромбоцитів та вивільнення молекул адгезії до ендотелію [7, 19]. Глікоокси-ЛПНЩ мають також імуногенні властивості — їх комплекси з антитілами ще більше стимулюють утворення пінистих клітин та посилюють агрегацію тромбоцитів [7]. Несприятливі впливи AGE підсумовані на рис. 1.
/94.jpg)
З огляду на зазначене AGE відіграють роль у патогенезі найрізноманітніших патологічних станів, зокрема артеріальної гіпертензії, судинних діабетичних ускладнень, нефропатії, атеросклерозу коронарних і/або периферійних артерій, хвороби Альцгеймера, деменції та зниженні когнітивних функцій, катаракти, передчасного старіння, втрати м’язової маси та злоякісних пухлин [2, 6, 7, 20].
Лабораторним критерієм процесу глікозилювання є HbA1с, хоча у науковій літературі зараз обговорюється клінічне значення іншого продукту глікозилювання — глікованого альбуміну. Визначення HbA1с може проводитись методами рідинної катіон-обмінної хроматографії під низьким тиском або електрофорезу. Нормою вважається 4–6 % від загального гемоглобіну, а критичним рівнем — 9,5 % [4, 6]. Проте, за нашими даними, високий нормальний вміст HbA1с 5,7–6,0 % слід також брати до уваги, оскільки саме він виявився точкою відсіку прогностичного аналізу несприятливих подій — виникнення ЦД та серцево-судинних ускладнень [2, 3, 21, 22]. Хибні результати вимірювання HbA1с можуть зустрічатись у вагітних, в осіб, які вживають алкоголь, опіати або великі дози аспірину (ацетильований гемоглобін), та отруєних свинцем, у пацієнтів із хронічною хворобою нирок та уремією, гемоглобінопатіями, залізодефіцитною анемією [2, 4].
Клінічне значення визначення HbA1с. Підвищення вмісту HbA1с є маркером поганого метаболічного контролю ЦД. Проте цим не обмежується його діагностико-прогностичне значення. Вищі показники HbA1с асоціюються з атерогенними дисліпідеміями, активацією симпатичної нервової системи, судинними ускладненнями ЦД, високим ризиком коронарної патології та атипового перебігу ІХС. Навіть високі нормальні значення HbA1с (≥ 5,7–6,0 %) вказують на інсулінорезистентність та високу ймовірність виникнення ЦД упродовж найближчих трьох років, дають можливість віддиференціювати гостру стресову гіперглікемію від хронічної, що дозволяє оптимізувати призначення гіпоглікемічних засобів.
1. Перш за все HbA1с вважається найкращим критерієм якості метаболічного контролю у хворих на ЦД [4]. Проведені нами обстеження пацієнтів з його підвищенням показали істотно вищі показники глікемії, площі під кривою глюкози, нижчу відповідь інсуліну на глюкозу, нижчі рівні секреції інсуліну та меншу чутливість до нього печінки і периферійних тканин [3, 21, 22]. Однак слід зважати на те, що HbA1с не завжди віддзеркалює рівень глюкози крові, оскільки у третини осіб з еуглікемією вміст HbA1с був підвищеним, а у п’ятої частини осіб з гіперглікемією натще значення HbA1с відповідали нормі [4, 23]. Це підтвердили і власні дані, за якими значення HbA1с перевищували 5,7 % лише у 62,5 % хворих на ЦД та, що більш важливо, у 16,7 % осіб з нормальними показниками глюкозотолерантного тесту, які у даному контексті потребують особливої уваги сімейних лікарів.
2. Рівень HbA1с є маркером активності синдрому запалення, про що свідчить виявлений нами істотно вищий вміст високочутливого С-реактивного протеїну за умов підвищення HbA1с (27,4 [25,1; 33,8] проти 26,1 [15,1; 29,2] мг/л в осіб з HbA1c < 5,7 %; р = 0,021). На думку гонконгського дослідника Т.С.Т. Fong (2019), підвищення маси тіла активує продукцію С-реактивного протеїну, який потім самостійно посилює процеси глікозилювання та прискорює утворення HbA1с [24].
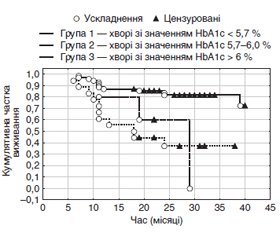
3. Зростання рівня HbA1с навіть до високих нормальних значень (5,7–6 %) є чутливим прогностичним маркером високого ризику цукрового діабету впродовж найближчих трьох років, що підтверджено власним проспективним дослідженням. Виявилось, що прогноз суттєво відрізнявся у групах із різним значенням HbA1с (χ2 = 14,89; p = 0,0006): ЦД виник у 18,8 % осіб з HbA1с < 5,7 %; 60,0 % осіб з HbA1с 5,7–6 % та у 61,1 % з HbA1с > 6 %, а кумулятивні частки виживання становили 72,7, 0 та 37,1 % відповідно (тест Кокса: р1–2 = 0,056, р1–3 = 0,0003, р2–3 > 0,05) (рис. 2).
/95.jpg)
4. Глікований гемоглобін є маркером інсулінорезистентності. За нашими даними, навіть високий нормальний вміст HbA1с (≥ 5,5 %) асоціюється зі зниженням індексів Gutt (46,7 [39,8; 55,9] проти 58,3 [50,2; 73,9]; р < 0,0001), Cederholm (31,5 [27,8; 38,7] проти 42,8 [34,0; 55,0]; р < 0,0001), Matsuda (2,64 [2,20; 3,96] проти 3,90 [2,85; 5,69]; р = 0,004), а отже, зі зниженням чутливості периферійних тканин до інсуліну. Саме інсулінорезистентність зумовлює розвиток метаболічного синдрому, який патогенетично об’єднує порушення вуглеводного й ліпідного обміну з артеріальною гіпертензією [3, 21, 22]. Цей аспект важливо брати до уваги в клініці, оскільки зниження чутливості тканин до інсуліну, яку можна діагностувати вже за верхніми нормальними значеннями HbA1с, завжди випереджає діабетичну гіперглікемію.
5. Глікований гемоглобін є маркером судинних ускладнень цукрового діабету, оскільки накопичення токсичних продуктів глікозилювання відбувається також субендотеліально і підвищує проникність ендотелію, адгезію клітин крові, хемотаксис моноцитів/макрофагів до артеріальної стінки, викликає проліферацію клітин гладких м’язів [4]. Описана пряма кореляція між рівнем HbA1с та судинним ендотеліальним фактором росту й ендотеліном-1 [25], хоча і не всіма дослідниками вона підтверджена [11]. За іншими даними, глікозилювання порушує ендотелійзалежну релаксацію судин через зменшення дії оксиду азоту [26] та пригнічує судинорозширювальні властивості еритроцитів [27]. На нашу думку, саме це зумовлює зміну клініки ІХС за умов (пре-)діабету, що проявляється більш тривалими і/або атиповими нападами стенокардії [3, 21, 22]. Проте думка науковців щодо впливу надмірного глікозилювання на ураження судин не є одностайною. Описані менш виражені судинні ураженні в осіб з високим рівнем HbA1с, ніж при незначному його підвищенні [28], а також відсутність зв’язку HbA1с із рівнем пульсового тиску при ЦД [29]. Однак ці дані лише підкреслюють потребу звертати увагу на високі нормальні показники HbA1с та визначати тактику ведення таких пацієнтів.
6. Глікований гемоглобін є маркером атерогенних дисліпідемій, оскільки корелює з рівнями тригліцеридів (ТГ), ЛПНЩ та атерогенністю сироватки [7, 19]. Власні дослідження показали, що у хворих на ІХС за умов HbA1с ≥ 5,7 % вміст у крові холестерину (ХС) ЛПВЩ був значно нижчим (0,95 [0,88; 1,08] проти 1,22 [0,93; 1,50] ммоль/л; р = 0,0003), а значення коефіцієнта атерогенності та відношення ТГ/ХС ЛПВЩ — вищими (4,09 [3,36; 5,70] проти 3,67 [2,54; 5,14]; р = 0,039; 1,71 [1,43; 2,10] проти 1,22 [0,80; 1,92]; р = 0,0007 відповідно). За даними Л.М. Стрільчук, індекс ТГ/ХС ЛПВЩ пов’язаний з активацією системного запалення та синдромом ендогенної інтоксикації (прямі кореляції з лейкоцитами крові τ = 0,41; р = 0,012 і загальним фібриногеном τ = 0,57; р = 0,006; креатиніном τ = 0,42; р = 0,014 і сечовиною τ = 0,40; р = 0,020) та схильністю до гіперкоагуляції (обернений зв’язок з протромбіновим часом τ = –0,49; р = 0,027) [30]. Імовірно, саме процеси глікозилювання патогенетично пов’язують вік, куріння, ЦД із запуском атерогенезу та прискоренням атеросклеротичного процесу, замикаючи порочне коло.
7. Разом із холестеролемією та гомоцистеїнемією HbA1с вважається незалежним прогностичним метаболічним маркером ризику коронарної патології, що дозволяє оцінити глобальний коронарний ризик не тільки у хворих на ЦД, але й у всіх інших категорій пацієнтів [4, 21].
8. Зростання рівня HbA1с у хворих на коронарну патологію до високих нормальних меж (5,5–6,0 %) та понад норму вказує на високу ймовірність атипового перебігу клінічних проявів ІХС, передусім больових нападів. За нашими даними, у таких пацієнтів удвічі частіше спостерігались атипові прояви гострого коронарного синдрому (43,6 проти 22,1 %; р = 0,019), а тривалість ангінозних приступів була довшою (20 [15; 30] проти 15 [10; 20] хвилин, р = 0,030).
9. Рівень HbA1с корелює із симпатикотонією, свідченням чого є виявлені нами істотно вищі значення частоти серцевих скорочень (88 [75; 100] проти 77 [65; 91] уд/хв; р = 0,031) та індексу симпатичної активації 55,5 [51,2; 60,5] проти 51,5 [46,8; 58,7] %; р = 0,041) у хворих на ІХС за умов значень HbA1с уже в межах високої норми (> 5,7 %). Активація симпатичної нервової системи викликає тахікардію, артеріальну гіпертензію, підвищує кардіоваскулярний ризик і ризик смерті.
10. Рівень HbA1с дозволяє диференціювати гостру стресову гіперглікемію від хронічної при ЦД, а відтак оптимізувати призначення гіпоглікемічних засобів [31]. Це особливо важливо у пацієнтів з гострим коронарним синдромом та іншими атеротромботичними ускладненнями (інсульти, тромбози тощо), в яких часто виникають гострі стресові гіперглікемії з нормальним умістом HbA1с [21].
Клінічне значення глікованого гемоглобіну продовжує вивчатись. Нові перспективи відкрились після встановлення факту підвищення вмісту HbA1с в осіб, інфікованих Helicobacter pylori [32], що визначає додаткові напрямки наукових та клінічних досліджень.
Висновки
1. Рівень HbA1с свідчить про вміст в організмі AGE, які стимулюють продукцію вільних радикалів та окисну модифікацію білків і ліпідів, зменшують клітинний транспорт, активують запальні цитокіни, викликають імунні реакції та мутації, підвищують активність молекул адгезії.
2. Глікований гемоглобін — маркер диференціації гострої стресової гіперглікемії від хронічної, поганого метаболічного контролю впродовж останніх трьох місяців, судинних діабетичних ускладнень, інсулінорезистентності та ймовірності виникнення цукрового діабету у найближчі 3 роки, а також атерогенної дисліпідемії, системного запалення та атеросклеротичного ураження артерій.
3. Вміст HbA1с слід контролювати не тільки у хворих на ЦД, але й в осіб похилого і старечого віку, курців, пацієнтів з атеросклеротичним ураженням судин та хелікобактерною інфекцією.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Список литературы
1. 2019 ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: The Task Force for diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and the European Association for the Study of Diabetes (EASD) https:/doi.org/10.1093/eurheartj/ehz486.
2. Radchenko O.M. Glycosylated haemoglobin — metabolic marker of impairment. Problems of Endocrine Pathology. 2008. 1. 104-107. (in Ukrainian)
3. Radchenko O.M., Korolyuk O.Ja. Glucose homeostasis impairment: changes of views during 40 years. Mìžnarodnij endokrinologìčnij žurnal. 2015. 2. 95-8. Режим доступу: http://nbuv.gov.ua/UJRN/Mezh_2015_ 2_19. (in Ukrainian)
4. Kojić D.S., Đerić M., Eremić K.N. Glycated hemoglobin A1c as a modern biochemical marker of glucose regulation. Med. Pregl. 2014. 67(9-10). 339-44.
5. Korolyuk O.Ja., Radchenko O.M., Gorbach L.О., Gorbach М.О. Pathogenetic mechanisms of glucose-insulin regulation in patients with ischemic heart disease with carbohydrate metabolism impairment. Medical Hydrology and Rehabilitation. 2010. 1. 76-85.
6. Review criteria for assessment of glycohemoglobin (glycated or glycosylated) hemoglobin in vitro diagnostic devices. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/review-criteria-assessment-glycohemoglobin-glycated-or-glycosylated-hemoglobin-vitro-diagnostic.
7. Alzahrani S.H., Baig M., Aashi M.M., Al-Shaibi F.K., Alqarni D.A., Bakhamees W.H. Association between glycated hemoglobin (HbA1c) and the lipid profile in patients with type 2 diabetes mellitus at a tertiary care hospital: a retrospective study. Diabetes Metab. Syndr. Obes. 2019. 12. 1639-44. doi: 10.2147/DMSO.S222271.
8. Bala M., Meenakshi, Aggarwal S. Correlation of body mass index and waist/hip ratio with glycated hemoglobin in prediabetes. EJIFCC. 2019. 30(3). 317-24. PMCID: PMC6803770. PMID: 31695588.
9. Urberg M., Shammas R., Rajdev K. The effects of cigarette smoking on glycosylated haemoglobin in nondiabetic individuals. J. Family Practice. 1989. 5. 1125-29. PMID: 2597247.
10. Van Putte L., De Schrijver S., Moortgat P. The effects of advanced glycation end products (AGEs) on dermal wound healing and scar formation: a systematic review. Scars, Burns & Healing. 2016. https://doi.org/10.1177/2059513116676828.
11. Bruno C.M., Meli S., Marcino M. et al. Plasma endotelin-1 levels and albumin excretion rate in nopmotensive, microalbuminuric type 2 diabetic patients. J. Biol. Regul. Homeost. Agents. 2002. 16(2). 114-17. PMID: 12144123.
12. Bhutto A.R., Abbasi A., Abro A.H. Correlation of Hemoglobin A1c with red cell width distribution and other parameters of red blood cells in type II diabetes mellitus. Cureus. 2019. 11(8). e5533. doi: 10.7759/cureus.5533.
13. Al-Kindi S.G., Refaat M., Jayyousi A., Asaad N., Al Suwaidi J., Abi Khalil C. Red cell distribution width is associated with all-cause and cardiovascular mortality in patients with diabetes. Biomed. Res. Int. 2017. 2017. 5843702. doi: 10.1155/2017/5843702.
14. Xanthopoulos A., Giamouzis G., Melidonis A., Kitai T., Paraskevopoulou E., Paraskevopoulou P., Patsilinakos S., Triposkiadis F., Skoularigis J. Red blood cell distribution width as a prognostic marker in patients with heart failure and diabetes mellitus. Cardiovasc. Diabetol. 2017. 16(1). 81. doi:10.1186/s12933-017-0563-1.
15. Thao M.T., Gaillard E.R. The glycation of fibronectin by glycolaldehyde and methylglyoxal as a model for aging in Bruch’s membrane. Amino Acids. 2016. 48(7). 1631-9. doi: 10.1007/s00726-016-2222-3.
16. Berlanga-Acosta J., Schultz G.S., López-Mola E., Guillen-Nieto G., García-Siverio M., Herrera-Martínez L. Glucose toxic effects on granulation tissue productive cells: the diabetics’ impaired healing. Biomed. Res. Int. 2013. 2013. 256043. doi:10.1155/2013/ 256043.
17. Jacobsen J.N., Steffensen B., Häkkinen L., Krogfelt K.A., Larjava H.S. Skin wound healing in diabetic β6 integrin-deficient mice. APMIS (Acta pathologica, microbiologica, et immunologica Scandinavica). 2010. 118(10). 753-64 DOI: 10.1111/j.1600-0463.2010.02654.x
18. Morey M., O’Gaora P., Pandit A., Hélary C. Hyperglycemia acts in synergy with hypoxia to maintain the pro-inflammatory phenotype of macrophages. PLoS One. 2019. 14(8). e0220577. doi: 10.1371/journal.pone.0220577.
19. Bucala R., Makita Z., Koschinsky T. et al. Lipid advanced glycosilation: pathway for lipid oxidation in vivo. Proc. Nation. Acad. Scien. USA. 1993. 90. 6434-38 doi: 10.1073/pnas.90.14.6434.
20. Kanaya A.M., Barret-Connor E., Gildengorin G., Yaffe K. Change in cognitive function by glucose tolerance status in older adults. A 4-year prospective study of the Rancho Bernardo Study Cogort. Arch. Int. Med. 2004. 174(12). 1327-33. PMID: 15226167.
21. Korolyuk O.Ja., Radchenko O.M., Gorbach L.О., Gorbach М.О. Peculiarities of diagnosis the first time appeared hyperglycemia in patients with ischemic heart disease. Circulation and haemostasis. 2011. 3–4. 23-8.
22. Radchenko O.M., Korolyuk O.Ja. Pecularities of ischemic heart disease course and treatment in patients with glucose metabolism impairment and diabetes mellitus. Mìžnarodnij endokrinologìčnij žurnal. 2015. 6(70). 11-5. (in Ukrainian)
23. Murray L., Jimenez-Navarrete A., Francisco M. Calidad del control glicemico segun la hemoglobina glicosidada vs la glicemia en ayunas; analisis en una poblacion urbana y otra rural de diabeticos costarricenses. Acta med. costarric. 2004. 46. 139-44.
24. Fong T.C.T. Indirect effects of body mass index growth on glucose dysregulation via inflammation: causal moderated mediation analysis. Obes. Facts. 2019. 12(3). 316-327. doi: 10.1159/000500422.
25. Itoh M., Kazikawa H., Itoh Y. et al. The relationship between glycemic control and plasma VEGF and ET-1 concentration in diabetic patients. 18th International Diabetes Federation Congress, France. 2003; Poster Display, № 2704.
26. Angulo J., Sanchez-Ferrer C.F., Peiro C. et al. Impairment of Endothelium-Dependent Relaxation by Increasing Percentages of Glycosylated Human Hemoglobin. Possible Mechanisms Involved. Hypertension. 1996. 28. 583-92.
27. James P.E., Lang D., Tufnell-Barret T. et al. Vasorelaxation by red blood cells and impairment in diabetes. reduced nitric oxide and oxygen delivery by glycated hemoglobin. Circulation Research. 2004. 94. 976-82. DOI: 10.1161/01.RES. 0000122044.21787.01.
28. Stagnaro-Neri M., Stagnaro S. Semeiotica Biofisica: la manovra di Ferrero-Marigo nella diagnosi clinica della hiperinsulinemia-insulinoresistenza. Acta Med. Medit. 1997. 13. 125-36.
29. Ugalde-Canitrot A., Bajo-Martinez A., Bernal E. et al. Evaluation of endothelial function and extracellular matrix turnover in type 2 diabetic patients with elevated ambulatory blood pressure. 18th International Diabetes Federation Congress, France. 2003; Poster Display: № 2703.
30. Strilchuk L.M. Calculated parameters of lipidogram: modern scientific positions and correlations with laboratory and instrumental parameters. Acta Medica Leopoliensia. 2017. XXIII(3). 72-8. (in Ukrainian)
31. Luethi N., Cioccari L., Tanaka A., Kar P., Giersch E., Deane A.M., Mårtensson J., Bellomo R. Glycated Hemoglobin A1c Levels Are Not Affected by Critical Illness. Crit. Care Med. 2016. 44(9). 1692-4. doi: 10.1097/CCM.0000000000001656.
32. Chen J., Xing Y., Zhao L., Ma H. The Association between Helicobacter pylori infection and glycated hemoglobin in diabetes: a meta-analysis. J. Diabetes Res. 2019. 3705264. doi: 10.1155/2019/3705264.
/95.jpg)

/94.jpg)