Вступ
Своєчасне розпізнавання й невідкладна терапія гострої ендокринної патології становить чималі труднощі для практикуючих лікарів різних спеціальностей. При цьому трапляються діагностичні помилки, зумовлені неправильною оцінкою анамнезу, об’єктивних клінічних даних та особливостей перебігу захворювання, що суттєво ускладнює його прогноз, спричинює інвалідність пацієнтів, а нерідко й летальні наслідки. Одним із таких станів є тиреотоксичний криз (ТК).
Визначення
ТК — це загрозливий для життя стан, що може розвинутися у хворого з некомпенсованим тиреотоксикозом, характеризується різким загостренням його клінічних проявів і прогресуючими розладами гомеостазу; за відсутності адекватного лікування, як правило, завершується летально.
Історія, термінологія
Уперше невідкладний стан, пов’язаний з гіпертиреозом, описаний в 1926 році [1], а 1930 року H. Zondek запропонував термін «тиреотоксичний криз» [2]. В аналогічному значенні використовувались поняття «тиреогенний криз», «гіпертиреоїдний криз», «тиреоїдний шторм», «прискорений (гострий) гіпертироїдизм», дещо згодом — «тиреотоксична енцефалопатія». Пізніше фінальна стадія цього критичного стану німецькими авторами була означена як «кома Базедова» (Coma basedowicum) [2]. Сьогодні найпоширенішим терміном в англомовній літературі є «thyroid storm». Окрім цього, ендокринні хірурги використовують поняття «гостра тиреотоксична реакція» у випадку транзиторного загострення симптоматики в ранньому післяопераційному періоді.
До середини ХХ сторіччя ТК траплявся принаймні в половини оперованих хворих із тиреотоксикозом, а летальність сягала 100 % [2, 3]; така ситуація спонукала до активізації наукових досліджень даної проблеми та вдосконалення практичних підходів стосовно її подолання. Зі зрозумілих причин цим найбільше переймалися хірурги, які практикували операції на щитоподібній залозі (ЩЗ).
В Україні до вирішення проблеми ТК у різні періоди доклали зусиль професори О.К. Горчаков, М.П. Черенько, І.В. Комісаренко, Г.Г. Караванов, О.Н. Люлька, П.О. Огій, Д.А. Макар, М.П. Павловський та низка інших дослідників. У світовому вимірі вагома частка наукових праць належить фахівцям зі США, Німеччини та Італії. Проте найбільш ґрунтовно до вивчення даного питання підійшли в Японії, де було здійснене унікальне дослідження в національному масштабі та в 2016 році опубліковані спільні настанови Японської тиреоїдологічної асоціації (ЯТА) та Японського товариства ендокринологів, спеціально присвячені менеджменту пацієнтів із ТК [4].
Епідеміологія
За даними літератури, захворюваність на ТК у даний час становить принаймні 0,2 випадку на 100 тис. населення або не більше ніж 1–2 % пацієнтів із явним гіпертиреозом, які потребували госпіталізації [5, 6]. У Японії частота ТК серед усіх госпіталізованих пацієнтів становить 10–20 на 100 000 за рік [7]. Упродовж 2001–2010 рр. у стаціонарах Німеччини щорічно перебували на лікуванні від 600 до 1100 хворих на ТК, при цьому помирали від 6 до 25 осіб [3]. Зауважимо, що істинну частоту цього ускладнення проблемно встановити через відсутність загальноприйнятих клінічних і специфічних лабораторних критеріїв.
Етіологія
Облігатною передумовою виникнення ТК є наявність синдрому тиреотоксикозу, причиною якого найчастіше виступає хвороба Грейвса — Базедова, рідше — функціональна автономія ЩЗ (вузлові форми токсичного зоба). Остання набуває вагомого значення в осіб старшого віку, котрі проживають у йододефіцитних регіонах і тривалий час страждають на зоб, особливо багатовузловий. Розвиток ТК на ґрунті тиреотоксикозу іншого генезу принципово можливий, проте трапляється винятково рідко.
Зазвичай ТК виникає під впливом ініціюючих (пускових) чинників, хоча в частини хворих їх не вдається верифікувати. Серед давно відомих тригерів найчастіше фігурують операційні втручання на ЩЗ або інших органах у хворих із некомпенсованим тиреотоксикозом; така ситуація можлива як у випадку раніше недіагностованого гіпертиреозу, так і порушення режиму лікування аж до раптового припинення антитиреоїдної терапії або ж її неефективності.
Загалом у ролі тригерів здатні виступати будь-які стресові чинники, які виснажують адаптаційні можливості організму, як-от: тяжкий емоційний стрес, фізична травма (описаний ТК навіть після грубої пальпації ЩЗ при великому зобі), гостре інфекційне чи неінфекційне захворювання, надмірна інсоляція, пологи, діабетичний кетоацидоз.
Траплялися випадки ТК на початковому етапі терапії тиреотоксикозу високими дозами радіоактивного йоду та пов’язані із застосуванням деяких лікарських засобів, особливо рентгеноконтрастних і аміодарону при парентеральному введенні, а також саліцилатів, адреноміметиків, клофібрату, серцевих глікозидів, сорафенібу (мультикіназний інгібітор для протипухлинної хіміотерапії) і навіть препаратів тиреоїдних гормонів (ТГ) у високих дозах.
Варто зазначити, що протягом останніх десятиліть частка названих чинників кардинально змінилася. Раніше в етіологічній структурі ТК абсолютно домінував операційно-наркозний стрес, однак сьогодні така ситуація стала рідкістю [5]. Натомість в наш час істотно зросла роль гострих інтеркурентних захворювань — інфекційних (особливо дихальних шляхів), кардіоваскулярних (гострий інфаркт міокарда, застійна серцева недостатність, тромбоемболія легеневої артерії, гостре порушення мозкового кровообігу) та ускладнень цукрового діабету (кетоацидоз, гіпоглікемія внаслідок передозування інсуліну).
Патогенез
Патогенез ТК, попри тривалу історію, вивчений недостатньо. Одна з перших теорій відводила головну роль раптовому підвищенню в крові концентрацій ТГ, причому за рахунок зменшення їх зв’язування з транспортними протеїнами сироватки відбувається зростання саме вільних фракцій (вT4, вT3). Не виключені також порушення внутрішньомембранних чи внутрішньоклітинних етапів транспорту ТГ, можливо, на тлі зміненої афінності ядерних рецепторів. Пізніше в багатьох дослідженнях було продемонстровано, що рівні ТГ при ТК та декомпенсованому (але неускладненому) тиреотоксикозі вірогідно не відрізняються, за винятком вільного T4 [1, 3, 5]. Стало очевидним, що збільшення концентрацій ТГ має вагоме значення, проте саме по собі не пояснює настання кризового стану, для цього необхідні додаткові передумови.
Інша гіпотеза оперує даними про взаємодію між ефектами циркулюючих гормонів ЩЗ та гіперактивності катехоламінів. Різке посилення їх впливів відбувається завдяки збільшенню кількості та чутливості адренорецепторів і модуляції пострецепторної передачі сигналу, оскільки вміст катехоламінів у крові та сечі нормальний [4, 8]. До того ж пригнічення на тлі гіпертиреозу активності моноаміноксидази в міокарді підвищує чутливість останнього до катехоламінів, сприяючи гемодинамічно неефективній тахікардії.
Ще однією не менш важливою ланкою патогенезу вважають прогресування недостатності кори надниркових залоз на ґрунті прискореного метаболізму кортизолу та підвищеної потреби організму в кортикостероїдах. Тривала інтоксикація ТГ та супутні їм метаболічні зрушення виснажують резерви кортикостероїдів в організмі, а будь-які додаткові стресові чинники сприяють маніфестації гіпокортицизму на тлі яскравої картини тиреотоксикозу. Крім цього, різні дослідники вказували на активацію калікреїн-кінінової системи, що проявляється зростанням вмісту брадикініну, кініногену та інших її компонентів. Наслідками цього є виражені розлади мікроциркуляції, розвиток прогресуючої гіпотензії та колапсу у фінальній стадії ТК.
Розвитку кризового стану безпосередньо сприяють тяжкі порушення біохімічних процесів на клітинному рівні, передусім окиснювального фосфорилювання, що унеможливлює засвоєння тканинами енергії, спрямовуючи її в непродуктивне русло надмірної теплопродукції. Гіперметаболічний стан призводить до посилення глікогенолізу, ліполізу та кетогенезу, а знижений кліренс молочної кислоти печінкою сприяє розвитку лактат-ацидозу та кетоацидозу.
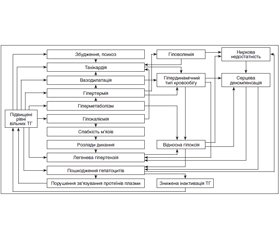
Таким чином, ТК виникає внаслідок складної взаємодії екзогенних і ендогенних чинників за відсутності єдиного патогенетичного механізму, його доцільно трактувати як варіант ендотоксичного шоку з розвитком поліорганної недостатності. Останню нині розглядають як стан, при якому неконтрольована реакція системного запалення та/або підвищений рівень цитокінів призводять до прогресуючого пошкодження двох і більше органів чи систем органів [4]. Схематично патогенез ТК, відповідно до сучасних уявлень, зображений на рис. 1.
Клінічна картина
У 70 % випадків ТК розвивається стрімко, лавиноподібно, а в 30 % хворих симптоми посилюються поступово впродовж кількох днів. Темп його розвитку визначається станом адаптаційних можливостей організму, інтенсивністю впливу та характером ініціюючого чинника. Скажімо, післяопераційний ТК зазвичай виникає на другу-третю добу після втручання, натомість йод-індукований криз відзначається тривалим латентним періодом, маніфестуючи через 3–10 тижнів і навіть пізніше [6]. У типових випадках клінічний перебіг ТК характеризується певною стадійністю.
1. Продромальні симптоми, які включають збудження, безсоння (нічні галюцинації та інші розлади психічної діяльності), значну втрату маси тіла, посилення м’язового тремору та гіпергідрозу, гарячку, нудоту і блювання; більшість з них спричинена гіперактивністю симпатоадреналової системи.
2. Розгорнутий криз, визначальними рисами якого є блискавичне загострення симптомів тиреотоксикозу, передусім з боку нервової, серцево-судинної і травної систем, ознаки зневоднення, прогресуюча поліорганна недостатність та розвиток коматозного стану.
Класична клінічна картина ТК настільки яскрава й характерна, що її, раз побачивши, легко запам’ятати на все життя. Вона включає лихоманку (до 38–41 °С), гіпергідроз, виражену тахікардію, серцеву недостатність, тремор, нудоту і блювання, діарею, зневоднення, екстремальне збудження, делірій або кому. У 90 % випадків виникають розлади ЦНС. На першому етапі переважають симптоми рухового і психічного збудження: пацієнти тривожні, емоційно нестійкі (плачуть, проявляють агресію, сміються), гіперактивні й не цілеспрямовані в поведінці, можливий розвиток психозу. Із прогресуванням кризу такий стан змінюється загальмованістю, апатією, емоційним отупінням, вираженою м’язовою слабкістю. Важливо пам’ятати, що психоневрологічні прояви ТК мають і прогностичне значення, оскільки їх швидке прогресування, як правило, є передвісником коматозного стану.
Тиреотоксична міопатія проявляється зниженням тонусу і швидкою стомлюваністю м’язів шиї, лопатки, рук і ніг, рідше — обличчя й тулуба. Можуть спостерігатися болі, мимовільні посмикування, судоми та напади гіпокаліємічного пароксизмального паралічу. Піт виділяється у величезній кількості, швидко підсилюючи дегідратацію.
Симптоми з боку шлунково-кишкового каналу включають нудоту, блювання, зниження апетиту, спастичний біль у животі, нестримну діарею і, як наслідок, втрату маси тіла. Гепатомегалія та аномальні тести функціонування печінки частіше спричинені серцевою недостатністю, однак іноді спостерігали жовтяницю з некрозом гепатоцитів.
Підвищується частота серцевих скорочень (до 140–200 за 1 хв), зростає пульсовий тиск, виникає задишка. Постійна форма фібриляції передсердь може призвести до застійної серцевої недостатності навіть в осіб, які не мали в анамнезі серцевих захворювань. Передвісником смерті хворого нерідко стає судинний колапс.
Слід узяти за правило: у разі раптового погіршання стану пацієнта з тиреотоксикозом завжди необхідно пам’ятати про можливість розвитку ТК, при цьому на перший план можуть виступати симптоми хвороби, що його спровокувала.
Атипові форми ТК
Інколи, зокрема в похилому віці, спостерігається апатичний (латентний) варіант кризу, що характеризується надзвичайною м’язовою слабкістю, загальмованістю, апатією, значним дефіцитом маси тіла та відсутністю гіпертермії, вираженого тремору і стадії збудження [5]. Незважаючи на завуальовану клінічну картину, у хворого може раптово настати кома і смерть.
Відомі випадки, коли першим і/або домінуючим проявом ТК виступав гострий психоз, до того ж у таких пацієнтів стандартна антитиреоїдна та підтримуюча терапія може виявитись неефективною [9]. Крім цього, ТК може імітувати загострення перебігу таких захворювань, як пептична виразка шлунка, бронхіальна астма, гостре порушення мозкового кровообігу, а також наявність у хворого ознак «гострого живота».
Діагноз
/115.jpg)
Діагноз ТК є за своєю суттю клінічним, оскільки жоден додатковий метод обстеження не може його надійно підтвердити або заперечити. Для полегшення цього завдання закономірно виникли певні клінічні інструменти. По-перше, різними дослідниками, починаючи з 1993 року, були запропоновані системи бальної оцінки, із яких найчастіше використовують шкалу Burch-Wartofsky (табл. 1) [5, 8, 10, 11]. Інтерпретація результату здійснюється так: < 25 балів — ТК малоймовірний; 25–44 бали — загроза кризу: слід провести ретельну клінічну оцінку перед прийняттям рішення про початок активної терапії; ≥ 45 балів — висока ймовірність ТК: необхідно негайно розпочати інтенсивну комплексну терапію. По-друге, в зарубіжній літературі набула поширення класифікація ТК за стадіями (табл. 2), що важлива в прогностичному плані [2, 3].
Як уже згадувалося, лабораторні та інструментальні обстеження відіграють лише допоміжну роль. За їх допомогою передусім можна виявити підвищення в сироватці концентрацій ТГ, особливо вільних, проте вони суттєво не відрізняються від тих, що спостерігаються при неускладненому тиреотоксикозі. Однак з огляду на тяжкість стану пацієнтів, а тим більше за наявності серйозних супутніх захворювань ці показники можуть бути неправдиво заниженими через паралельний розвиток синдрому нетиреоїдних захворювань 1-го або 2-го типу (відповідно, варіант «низького T3» або «низьких Т4/Т3»). Ще однією причиною хибних результатів лабораторного дослідження може бути вплив різноманітних лікарських засобів, надто в умовах поліпрагмазії.
Також часто виявляють помірну гіперглікемію, лейкоцитоз із зсувом формули вліво (навіть за відсутності інфекційно-запального процесу!), зростання показників білірубіну, амінотрансфераз, лактатдегідрогенази, лужної фосфатази та підвищення рівня кортизолу (на початкових стадіях), що є типовим для стресових станів. Крім цього, до обов’язкових обстежень зараховують моніторинг ЕКГ, ехокардіографію, рентгенографію органів грудної клітки, посів крові та сечі, визначення показників електролітного та кислотно-лужного балансу. Зокрема, на ЕКГ фіксують синусову тахікардію, фібриляцію передсердь, зміну амплітуди зубця Т і комплексу QRS, інколи — порушення провідності серця.
Заслуговує на увагу недавно опублікована праця японських дослідників, присвячена пошуку клінічних, біохімічних, ендокринологічних та імунологічних відмінностей у двох групах пацієнтів із хворобою Грейвса — з розвитком ТК і без нього [12]. У першій групі серед іншого спостерігали більший відсоток чоловіків, суттєво вищі рівні в сироватці крові лужної фосфатази, ТГ та антитіл до рецептора тиреотропного гормону, також автори вказують на менш суттєві відмінності в параметрах лейкоцитарної формули та ліпідограми.
Диференціальна діагностика
У випадку неповної клінічної картини ТК або атипового перебігу виникає потреба в диференціальній діагностиці даного стану:
— із гострим гіпокортицизмом іншого генезу;
— гострою серцево-судинною недостатністю нетиреогенного походження;
— інфекціями та інтоксикаціями (сепсис, харчова токсикоінфекція, двобічна пневмонія, уремія, печінкова енцефалопатія);
— гострим психозом, делірієм, злоякісним нейролептичним синдромом;
— синдромом «гострого живота»;
— бронхіальною астмою;
— неврологічною патологією (енцефаліт, інсульт).
Розпізнати ТК допомагають анамнестичні та клінічні вказівки на хворобу Грейвса — Базедова (зоб, екзофтальм, значне схуднення, високий пульсовий тиск) або інше захворювання ЩЗ, яке супроводжувалось тривалим некомпенсованим тиреотоксикозом та впливом на організм відомих провокуючих чинників.
Більшість фахівців вважає, що в сумнівних випадках краще помилитися щодо припущення про наявність ТК в даний момент або загрозу його розвитку і все-таки розпочати інтенсивну терапію, аніж проґавити діагноз.
Лікування
ТК належить до ургентних клінічних ситуацій, тому вже сама підозра на це ускладнення змушує вдатись до невідкладних лікувальних заходів, бажано в умовах відділення реанімації та інтенсивної терапії для збільшення шансів на виживання. Окрім терапії самого кризу, важливим є максимально можливий вплив на провокуючі фактори, як-от: інфекції чи серцево-судинні події. Оскільки випадки ТК взагалі доволі рідкісні, стає цілком зрозумілою майже повна відсутність рандомізованих контрольованих досліджень стосовно вибору лікування, тому наведені нижче рекомендації значною мірою базуються на думках експертів, які знайшли відображення в міжнародних настановах (ЕТА-2018 [10], АТА-2016 [11], особливо ЯТА-2016 [4]) та інших джерелах.
Стандартну терапевтичну програму прийнято поділяти на декілька розділів (напрямків), перелік яких у різних фахівців дещо різниться, проте в будь-якому разі такий поділ є доволі умовним; ми вважаємо за доцільне виокремити такі.
І. Специфічні заходи — спрямовані на зниження синтезу та секреції ТГ, ослаблення їх периферичних ефектів, ліквідацію дефіциту кортикостероїдів.
1. Застосування антитиреоїдних засобів (тиреостатиків) є найбільшою мірою патогенетичним, виходячи з теоретичних міркувань. Препаратом вибору прийнято вважати пропілтіоурацил, оскільки він має додатковий ефект — інгібує дейодиназу 1-го типу, гальмуючи периферичну конверсію ТГ; призначають спочатку 500–1000 мг, далі по 200–300 мг кожних 6 годин всередину. Альтернативним засобом служить тіамазол (метимазол) по 20–40 мг кожних 6–8 годин всередину. До речі, японські дослідники не знайшли істотних переваг пропілтіоурацилу над тіамазолом [7], що є актуальним з огляду на його меншу доступність та вищу гепатотоксичність; з ними солідарні деякі німецькі автори [3]. На практиці пероральне вживання ліків зазвичай неможливе, тому намагаються використовувати інші шляхи введення — через назогастральний зонд (розчинивши препарат у 100–150 мл 5% розчину глюкози), ректально або внутрішньовенно (парентеральна форма тіамазолу*). Принциповим моментом є те, що тиреостатики гальмують синтез нових порцій ТГ, жодним чином не впливаючи на вже депоновані у тиреоїдній тканині та їх вивільнення в кров; через це даний підхід сам по собі не може бути ефективним при ТК.
2. Неорганічний йод у фармакологічних дозах, як відомо, проявляє специфічний вплив на функцію ЩЗ: блокує фазу органіфікації (ефект Вольфа — Чайкова) і протеоліз тиреоглобуліну, тобто надходження в кров ТГ. Препарати йоду є обов’язковим компонентом терапії ТК, проте їх починають вводити не раніше ніж через 1–2 години після першого застосування тиреостатиків (!), щоб не допустити тимчасового посилення синтезу ТГ. Використовують один із варіантів: 10% розчин натрію йодиду по 5–10 мл кожних 8 годин внутрішньовенно; розчин Люголя по 1 мл кожних 8 годин в/в або 30–50 крапель 3 рази/добу перорально. Орієнтовна добова доза в перерахунку на йод становить від 200 до 800 мг, зазвичай упродовж 7–10 днів. Повідомлялося про застосування як альтернативи окремих рентгеноконтрастних засобів (іподат натрію*, йопаноєва кислота*), проте вони в даний час недоступні в багатьох країнах [11]. У хворих, котрі мають гіперчутливість до йоду, на початковій стадії ТК може бути використаний літію карбонат по 300 мг кожних 6 год (цільовий рівень літію в крові 0,9–1,2 ммоль/л).
3. Компенсацію дефіциту кортикостероїдів забезпечують введенням гідрокортизону гемісукцинату одразу 300 мг, надалі по 100 мг кожних 6–8 годин внутрішньовенно (300–500 мг/добу) або преднізолону по 30–60 мг кожних 6–8 годин внутрішньовенно (120–240 мг/добу); альтернативу може становити дексаметазон по 2 мг кожних 6–8 годин внутрішньовенно (6–8 мг/добу) чи інший засіб цієї групи. У рефрактерних випадках дози препаратів необхідно збільшити, і навпаки, в разі позитивної динаміки стану хворого дози глюкокортикоїдів через 2 доби поступово зменшують. Високі дози цих препаратів також пригнічують периферичний метаболізм йодотиронінів, що додає їм цінності в терапії ТК.
4. Зменшення ефектів катехоламінів, насамперед кардіоваскулярних, меншою мірою психоневрологічних, досягають за допомогою β-адреноблокаторів під контролем гемодинамічних параметрів. Зазвичай надають перевагу пропранололу, котрий, на відміну від селективних β-адреноблокаторів, додатково гальмує периферичну конверсію ТГ. Уводять по 0,5–3 мг кожних 3–6 годин внутрішньовенно повільно (на 10 мл ізотонічного розчину натрію хлориду). Досвід США свідчить про ефективність високих доз пропранололу (по 60–120 мг кожних 6 год перорально), водночас частина фахівців надає перевагу есмололу — β-блокатору ультракороткої дії, що вводять внутрішньовенно у початковій дозі 0,25–0,5 мг/кг кожних 5–10 хв, а далі шляхом інфузії з розрахунку 0,05–0,1 мг/кг/хв; подібні властивості також має ландіолол*. За наявності протипоказань (виражений бронхообструктивний синдром, цукровий діабет) можливе введення метопрололу тартрату по 5–10 мг кожних 6–8 годин внутрішньовенно повільно або блокаторів кальцієвих каналів (верапаміл, дилтіазем).
Щодо застосування β-адреноблокаторів постає певна дилема. З одного боку, терапія цими засобами, як відомо, потребує обережності при значно зниженій скоротливій функції міокарда. З іншого боку, саме при ТК серцеву недостатність не вважають суворим протипоказанням до використання β-адреноблокаторів, оскільки вони ефективно пригнічують ті патологічні механізми, які її спричинили. Дослідження в Японії продемонструвало вищу смертність хворих, пролікованих неселективними β-адреноблокаторами порівняно із селективними [7].
ІІ. Симптоматична та підтримуюча терапія.
Седативна терапія необхідна головним чином у І стадії ТК і потребує застосування сильнодіючих анксіолітиків (діазепам 10 мг внутрішньовенно) або антипсихотичних засобів (левомепромазин 12,5–25 мг внутрішньовенно; галоперидол 5–10 мг внутрішньом’язово), при судомах — діазепаму, фенітоїну або фенобарбіталу. Дозування психотропних препаратів дуже індивідуальне, оскільки їх фармакокінетика може змінюватись через ураження органів, відповідальних за метаболізм ліків [4]. Залежно від динаміки психічного статусу можливе або повторне їх застосування, або зменшення дози чи перехід на пероральний шлях уведення.
У боротьбі з гіпертермією слід використовувати головним чином фізичні методи, як-от: ємкості з льодом на ділянки магістральних судин і голови, вологі обтирання, охолодження з допомогою вентилятора. Припустиме застосування парацетамолу, зокрема ректально, проте в жодному разі саліцилатів, оскільки вони конкурують з ТГ за транспортні протеїни, підсилюючи тиреотоксикоз.
Корекцію порушень основних ланок гомеостазу здійснюють відповідно до загальних принципів інтенсивної терапії (сольові розчини, глюкоза, плазмозамінники тощо). Враховуючи специфіку метаболічних процесів при ТК, слід забезпечити організм енергетичними ресурсами з розрахунку 2000–3000 ккал/добу, при потребі використовуючи напрацьовані методики парентерального харчування.
За наявності показань лікування інших ускладнень та супутньої патології здійснюють відповідно до прийнятих алгоритмів. Ідеться, зокрема, про гостру судинну (колапс) та лівошлуночкову (набряк легень) недостатність, фібриляцію передсердь та інші порушення серцевого ритму, тромбоемболічні події, інфекційно-запальні процеси; тим паче, що деякі з них самі можуть спровокувати ТК. Причому активну антибактеріальну терапію рекомендують навіть при найменшій підозрі на інфекційно-запальний процес.
Лікування у рефрактерних випадках. У разі неефективності стандартної схеми лікування впродовж 24–48 годин доцільно розглянути такі додаткові можливості.
Еферентна терапія (зазвичай плазмаферез, рідше — гемосорбція чи діаліз) дає хворому реальний шанс завдяки швидкій елімінації з кров’яного русла надлишку ТГ та інших токсичних метаболітів; через це рекомендується багатьма фахівцями та експертами за умови прогресування поліорганної (особливо печінкової) недостатності [4, 5, 13]. Щоправда, існують застереження, які стосуються ефекту «рикошету» з повторним підйомом концентрацій ТГ, додаткового навантаження на систему кровообігу, впливу високих доз гепарину на зв’язування ТГ з транспортними протеїнами та ризику тромбоцитопенії [3]. У даний час відсутні проспективні дослідження, що б переконливо доводили ефективність такої тактики [4].
Тиреоїдектомія в ургентному порядку, попри підвищений операційний ризик, здатна суттєво поліпшити результати лікування пацієнтів із ТК за умови неефективності стандартної фармакотерапії при збереженій ЩЗ. Доволі революційна ідея ранньої операції при йод-індукованому ТК зародилася у провідних клініках Німеччини у 80-х роках ХХ сторіччя (Dralle H., Herrmann J., Röher H. та інші відомі хірурги), згодом поширилась як усередині країни, так і на інші європейські центри. У США тривалий час стримано сприймали такий підхід, однак сьогодні від нього не відмовляються й тамтешні фахівці [1, 5, 11].
Відомі приклади вдалого поєднання в одного пацієнта різних методів. На сайті клініки Мейо описаний унікальний клінічний випадок ТК, що розвинувся в 33-річної жінки через півроку після пологів на ґрунті недіагностованої хвороби Грейвса [14]. Незважаючи на інтенсивну терапію, стан пацієнтки залишався тяжким через прогресування гемодинамічних розладів аж до кардіогенного шоку; з метою тимчасової підтримки серцевої діяльності додатково застосовано метод екстракорпоральної мембранної оксигенації. Оскільки через п’ять днів пацієнтка все ще перебувала в критичному стані, спричиненому тиреотоксикозом, вирішено розпочати плазмаферез з метою швидкої підготовки до здійснення тиреоїдектомії. У післяопераційному періоді стан пацієнтки суттєво поліпшився, однак скоротлива функція серця залишалась вкрай низькою (фракція викиду 15 %), тому було застосовано кардіостимуляцію та рекомендовано трансплантацію серця.
Особливості лікарської тактики в нестандартних ситуаціях. Ідеться про ті нечасті випадки ТК, в основі яких лежать інші причини, аніж хвороба Грейвса — Базедова; вони потребують суттєвої корекції наведеної вище стандартної схеми. Скажімо, при тиреопатіях, що супроводжуються деструктивним тиреотоксикозом (підгострий тиреоїдит де Кервена, аміодарон-індукований тиреотоксикоз 2-го типу), використання тиреостатиків і препаратів йоду абсолютно не доцільне; акцент зміщується на активну протизапальну терапію глюкокортикоїдами або нестероїдними протизапальними засобами та симптоматичне лікування. При ТК, спричиненому значним передозуванням екзогенних ТГ, необхідна передусім їх негайна відміна, а також комплекс підтримуючих заходів.
Найбільш проблематичним вважається лікування йод-індукованого ТК у пацієнтів із функціональною автономією ЩЗ (включаючи аміодарон-індукований тиреотоксикоз 1-го типу), що, як відомо, відзначається рефрактерністю навіть до максимальних доз тиреостатиків. У таких випадках інтенсифікують антитиреоїдну та системну підтримуючу терапію, категорично уникаючи препаратів йоду. При цьому дози тіамазолу інколи сягають 80–160 мг/добу, карбімазолу — 120–180 мг/добу (!), через це оптимальним виходом у такій ситуації вважають невідкладну тиреоїдектомію, краще після підготовки за допомогою плазмаферезу [2, 6, 15]. Більше того, деякі автори наполягають на її проведенні впродовж 12–24 годин, адже летальність після операції, здійсненої в І–ІІ стадіях ТК, перебуває в межах 10 %, а в ІІІ стадії — 28,6 % [6].
Прогноз
Завдяки створенню і впровадженню у широку клінічну практику антитиреоїдних лікарських засобів, β-адреноблокаторів, нейролептиків та інших лікувальних заходів летальність при ТК кардинально знизилась і вже у 1990-х становила 20–50 % залежно від стадії [2]. Сьогодні, за даними ЕТА, летальність становить близько 10 % [10], інші автори озвучують 10–20 % [1, 3–5]. Вірогідними предикторами песимістичного прогнозу служать прогресуючі гіпертермія, тахіаритмія та порушення діяльності ЦНС, а також приєднання жовтяниці. Смерть може настати внаслідок серцевої та/або дихальної недостатності, шоку, поліорганної недостатності, гіпертермії, дисемінованої внутрішньосудинної коагуляції, сепсису або інших ускладнень. Зрештою, якщо пацієнти виживають, у частини з них спостерігаються необоротні розлади, як-от: постгіпоксична енцефалопатія, цереброваскулярна патологія, атрофія м’язів, психози або ниркова недостатність [4, 5].
Перспективи в лікуванні ТК
Японські фахівці у своїх настановах [4] сформулювали низку проблемних питань, розробка яких, на їх думку, може позитивно вплинути на результати лікування ТК. Серед них:
— Який тиреостатик краще підходить для терапії — тіамазол чи пропілтіоурацил?
— Чи впливає терапія глюкокортикоїдами на кінцевий прогноз?
— Наскільки необхідна терапія психотропними засобами при легких розладах свідомості?
— Чи можуть ранні заходи з реабілітації запобігти неврологічним ускладненням ТК?
Окрім цього, японські експерти наголошують на двох аспектах, які доцільно зробити предметом майбутніх клінічних досліджень: лікування порушень коагуляції і терапевтичний плазмаферез. Також, на нашу думку,заслуговує на подальше вивчення ще один аспект: ефективність і безпечність ранньої тиреоїдектомії.
Профілактика
Світова клінічна практика однозначно продемонструвала виняткову важливість профілактики ТК, основні принципи якої цілком зрозумілі:
— належна підготовка хворих на гіпертиреоз до хірургічного втручання чи радіойодтерапії;
— уникнення або мінімізація впливу відомих ініціюючих чинників;
— адекватне лікування та моніторинг основного захворювання, котре спричинило тиреотоксикоз.
Кожен пацієнт, навіть із добре контрольованим тиреотоксикозом, повинен бути поінформований про необхідність якнайшвидшого контакту з лікуючим лікарем у разі незрозумілої зміни стану, приєднання будь-якого серйозного захворювання, необхідності ургентного чи планового хірургічного втручання, настання психотравмуючої ситуації або вагітності. Адже лише адекватна оцінка ситуації та своєчасна корекція лікувальної тактики дають змогу запобігти розвитку такого грізного ускладнення, яким є ТК.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
/115.jpg) Діагноз ТК є за своєю суттю клінічним, оскільки жоден додатковий метод обстеження не може його надійно підтвердити або заперечити. Для полегшення цього завдання закономірно виникли певні клінічні інструменти. По-перше, різними дослідниками, починаючи з 1993 року, були запропоновані системи бальної оцінки, із яких найчастіше використовують шкалу Burch-Wartofsky (табл. 1) [5, 8, 10, 11]. Інтерпретація результату здійснюється так: < 25 балів — ТК малоймовірний; 25–44 бали — загроза кризу: слід провести ретельну клінічну оцінку перед прийняттям рішення про початок активної терапії; ≥ 45 балів — висока ймовірність ТК: необхідно негайно розпочати інтенсивну комплексну терапію. По-друге, в зарубіжній літературі набула поширення класифікація ТК за стадіями (табл. 2), що важлива в прогностичному плані [2, 3].
Діагноз ТК є за своєю суттю клінічним, оскільки жоден додатковий метод обстеження не може його надійно підтвердити або заперечити. Для полегшення цього завдання закономірно виникли певні клінічні інструменти. По-перше, різними дослідниками, починаючи з 1993 року, були запропоновані системи бальної оцінки, із яких найчастіше використовують шкалу Burch-Wartofsky (табл. 1) [5, 8, 10, 11]. Інтерпретація результату здійснюється так: < 25 балів — ТК малоймовірний; 25–44 бали — загроза кризу: слід провести ретельну клінічну оцінку перед прийняттям рішення про початок активної терапії; ≥ 45 балів — висока ймовірність ТК: необхідно негайно розпочати інтенсивну комплексну терапію. По-друге, в зарубіжній літературі набула поширення класифікація ТК за стадіями (табл. 2), що важлива в прогностичному плані [2, 3]./116.jpg)

/114.jpg)