Международный эндокринологический журнал Том 16, №4, 2020
Вернуться к номеру
Дисфункція щитоподібної залози й серцево-судинні захворювання: стан проблеми, шляхи вирішення
Авторы: Нетяженко В.З., Ляхоцька А.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Державна наукова установа «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
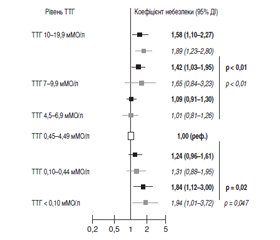
Захворювання щитоподібної залози значно поширені і є найбільш частою ендокринною патологією, особливо в регіонах із недостатнім вмістом йоду в довкіллі. Дисфункція щитоподібної залози діагностується в 5–10 % населення, частіше в жінок і у віковій групі старше від 60 років. Зі збільшенням віку частота виникнення коморбідних захворювань у пацієнтів значно зростає. Серед них перше місце посідає патологія серцево-судинної системи. Як один з факторів можна виділити ендотеліальну дисфункцію, що є одним із предикторів морфологічних змін судинної стінки при багатьох хронічних захворюваннях, зокрема при атеросклерозі, артеріальній гіпертензії, хворобах щитоподібної залози тощо.
Заболевания щитовидной железы широко распространены и являются наиболее частой эндокринной патологией, особенно в регионах с недостаточным содержанием йода в окружающей среде. Дисфункция щитовидной железы диагностируется у 5–10 % населения, чаще у женщин и в возрастной группе старше 60 лет. С увеличением возраста возникновение коморбидных заболеваний у пациентов значительно возрастает. Среди них первое место занимает патология сердечно-сосудистой системы. В качестве одного из факторов можно выделить эндотелиальную дисфункцию, которая является одним из предикторов морфологических изменений сосудистой стенки при многих хронических заболеваниях, в частности при атеросклерозе, артериальной гипертензии, заболеваниях щитовидной железы и др.
Thyroid diseases are widespread and are the most common endocrine pathology, especially in regions with iodine deficiency in the environment. Thyroid dysfunction is diagnosed in 5–10 % of the population, more often in women and in the age group over 60 years. With increasing age, the occurrence of comorbid diseases in patients is increasing significantly. Among them, the first place belongs to the pathology of the cardiovascular system. One of the factors is endothelial dysfunction, which is one of the predictors of morphological changes in the vascular wall in many chronic diseases, in particular, atherosclerosis, arterial hypertension, thyroid diseases, and others.
щитоподібна залоза; тиреотропний гормон; субклінічний гіпотиреоз; субклінічний гіпертиреоз; атеросклероз; серцева недостатність
щитовидная железа; тиреотропный гормон; субклинический гипертиреоз; атеросклероз; сердечная недостаточность
thyroid gland; thyroid-stimulating hormone; subclinical hypothyroidism; subclinical hyperthyroidism; atherosclerosis; heart failure
/57.jpg)
Висновки
- Показники здоров’я населення та використання ресурсів охорони здоров’я в Україні за 2017 рік / Центр медичної статистики. K., 2017.
- Показники лікарняної летальності в Україні за 2018 рік / Центр медичної статистики. K., 2018.
- Rugge J., Bougatsos C., Chou R. Screening and Treatment of Thyroid Dysfunction: An Evidence Review for the U.S. Preventive Services Task Force. Ann. Intern. Med. 2015. 162(1). 35-45.
- Rodondi N., den Elzen W.P., Bauer D.C. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA. 2010. 304(12). P. 1365-1374.
- Biondi B., Bartalena L., Cooper D.S. et al. The 2015 European Thyroid Association Guidelines on diagnosis and treatment of endogenous subclinical hyperthyroidism. Eur. Thyroid J. 2015. 4. 149-163.
- Udovcic M., Pena R., Patham B. et al. Hypothyroidism and the heart. Methodist Debakey Cardiovasc. J. 2017. 13(2). 55-59. doi: 10.14797/mdcj-13-2-55.
- Pankiv V.I., Yuzvenko T.Yu., Pankiv I.V. Type 2 diabetes mellitus and subclinical hypothyroidism: focusing on the role of cholecalciferol. Problems of Endocrine Pathology. 2019. 2. 46-51. Doi 10.21856/j-PEP.2019.2.07
- Jabbar A., Pingitore A., Pearce S.H. et al. Thyroid hormones and cardiovascular disease. Nat. Rev. Cardiol. 2017. 14(1). 39-55.
- Asvold B.O., Vatten L.J., Nilsen T.I., Bjøro T. The association between TSH within the reference range and serum lipid concentrations in a population-based study. The HUNT Study. Eur. J. Endocrinol. 2007. 156(2). 181-186.
- Pingitore A., Landi P., Taddei M.C. et al. Triiodothironine levels for risk stratification of patients with chronic heart failure. Am. J. Med. 2005. Vol. 118. P. 132-136.
- Rodondi N., Bauer D.C., Cappola A.R. et al. Subclinical thyroid dysfunction, cardiac function, and the risk of heart failure. The Cardiovascular Health study. J. Am. Coll. Cardiol. 2008. 52(14). 1152-1159.
- Floriani C., Gencer B., Tingh-Hai C., Rodondi N. Subclinical thyroid dysfunction and cardiovascular diseases: 2016 update. European Heart Journal. 2018. 39(7). 503-507.
- Knuuti J., Wijns W., Saraste A. еt al. 2019 ESC Guidelines for the diagnosis anf management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology. European Heart Journal. 2020. 41(3). 407-477.
- Пашковська Н.В. Псевдотиреоїдна дисфункція в клінічній практиці: як уникнути діагностичних помилок. Міжнародний ендокринологічний журнал. 2018. 14(4). 344-353. doi: 10.22141/2224-0721.14.4.2018.140188.
- Ponikowski P., Voors A., Anker S. et al. 2016 ESC Guidelines and treatment of acute and chronic heart failure: The Task Force for the diagnosis and management of acute and chronic heart failure of the European Society of cardiology. Developed with the special contribution of the Heart Failure Assosiation of the ESC. European Heart Journal. 2016. 37(27). 2129-2200.

/56.jpg)