Международный эндокринологический журнал Том 16, №7, 2020
Вернуться к номеру
Діабетична кардіоміопатія: класифікація, інструментальні методи діагностики
Авторы: Сергієнко О.О., Сергієнко В.О.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
В огляді наведена міжнародна класифікація, детально проаналізовані сучасні інструментальні методи діагностики діабетичної кардіоміопатії. Зокрема, проведений аналіз особливостей виконання і діагностичних критеріїв ехокардіографії, традиційної допплер-ехокардіографії, тканинної допплерографії, ехокардіографії з контрастуванням контрастними агентами другого покоління, акустичної допплер-ехокардіографії, тривимірної ехокардіографії, спекл-трекінг-ехокардіографії, магнітно-резонансної томографії, кардіоваскулярної магнітно-резонансної томографії, магнітно-резонансного томографічно-градієнтного ехо, фазово-контрастної магнітно-резонансної томографії, магнітно-резонансної томографії з радіоактивним фармпрепаратом, мультиспіральної комп’ютерної томографії, однофотонної емісійної комп’ютерної томографії, G-однофотонної емісійної комп’ютерної томографії та позитронно-емісійної томографії. Діабетична кардіоміопатія виникає досить часто і тривалий час має безсимптомний характер, що потребує динамічного спостереження та прицільного обстеження з метою її ранньої діагностики. На сьогодні існує ціла низка інформативних інструментальних методів обстеження, що істотно розширюють діагностичні можливості та в конкретній ситуації дають можливість отримати адекватну картину стану серцево-судинної системи. Патогенетично діабетична кардіоміопатія — це обмінна міокардіодистрофія, пов’язана з порушенням енергозабезпечення клітин, синтезу білків, електролітного обміну, обміну мікроелементів, окисно-відновних процесів, киснево-транспортної функції крові. Значна роль у її формуванні належить мікроангіопатіям і дисгормональним розладам. У хворих переважають дистрофічні зміни в міокарді, до яких приєднуються мікросудинні ураження з розвитком клінічних проявів некоронарогенної (неатеросклеротичної) ішемічної хвороби серця, виникненням інфаркту міокарда, не пов’язаного з ішемічною хворобою серця атеросклеротичного походження.
В обзоре приведена международная классификация, подробно проанализированы современные инструментальные методы диагностики диабетической кардиомиопатии. В частности, проведен анализ особенностей проведения и диагностических критериев эхокардиографии, традиционной допплер-эхокардиографии, тканевой допплерографии, эхокардиографии с контрастированием контрастными агентами второго поколения, акустической допплер-эхокардиографии, трехмерной эхокардиографии, спекл-трекинг-эхокардиографии, магнитно-резонансной томографии, кардиоваскулярной магнитно-резонансной томографии, магнитно-резонансного томографически-градиентного эхо, фазово-контрастной магнитно-резонансной томографии, магнитно-резонансной томографии с радиоактивным фармпрепаратом (меткой), мультиспиральной компьютерной томографии, однофотонной эмиссионной компьютерной томографии, G-однофотонной эмиссионной компьютерной томографии и позитронно-эмиссионной томографии. Диабетическая кардиомиопатия возникает довольно часто и длительное время имеет бессимптомный характер, что требует динамического наблюдения и прицельного обследования с целью ее ранней диагностики. На сегодняшний день существует целый ряд информативных инструментальных методов обследования, которые существенно расширяют диагностические возможности и в конкретной ситуации дают возможность получить адекватную картину состояния сердечно-сосудистой системы. Патогенетически диабетическая кардиомиопатия — это обменная миокардиодистрофия, связанная с нарушением энергообеспечения клеток, синтеза белков, электролитного обмена, обмена микроэлементов, окислительно-восстановительных процессов, кислородно-транспортной функции крови. Значительная роль в ее формировании принадлежит микроангиопатии и дисгормональным расстройствам. У больных преобладают дистрофические изменения в миокарде, к которым присоединяются микрососудистые поражения с развитием клинических проявлений некоронарогенной (неатеросклеротической) ишемической болезни сердца, возникновением инфаркта миокарда, не связанного с ишемической болезнью сердца атеросклеротического происхождения.
This review presents the international classification, analyzes in detail modern instrumental methods for the diagnosis of diabetic cardiomyopathy. In particular, the analysis was carried out of the features and diagnostic criteria of echocardiography, conventional Doppler echocardiography, tissue Doppler imaging, intravenous echocardiography using second-generation contrast agents, Dоppler acoustic echocardiography, three-dimensional echocardiography, speckle tracking echocardiography, magnetic resonance imaging, cardiovascular magnetic resonance imaging, gradient echo magnetic resonance imaging, phase contrast magnetic resonance imaging, tagged magnetic resonance imaging, multi-slice computed tomography, radionuclide myocardial perfusion imaging using ECG-gated single-photon emission computed tomography and positron emission tomography. Diabetic cardiomyopathy occurs quite often and for a long time is asymptomatic, which requires dynamic monitoring and targeted examination for early diagnosis. There are a number of informative instrumental methods of examination, which significantly expand the diagnostic possibilities and in a particular situation provide an opportunity to get an adequate picture of the cardiovascular system. Pathogenetically, diabetic cardiomyopathy is a metabolic myocardial dystrophy associated with impaired cell energy supply, protein synthesis, electrolyte exchange, micronutrient metabolism, redox processes, oxygen transport function of the blood. A significant role in its formation belongs to microangiopathies and hormonal disorders. Patients predominantly have dystrophic changes in the myocardium, which are joined by microvascular lesions with the development of clinical manifestations of non-coronary (non-atherosclerotic) ischemic heart disease, the onset of myocardial infarction not associated with coronary heart disease of atherosclerotic origin.
цукровий діабет; діабетична кардіоміопатія; інструментальні методи діагностики; огляд
сахарный диабет; диабетическая кардиомиопатия; инструментальные методы диагностики; обзор
diabetes mellitus; diabetic cardiomyopathy; instrumental methods of diagnosis; review
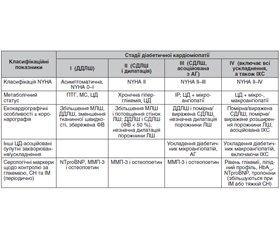
Інструментальні методи діагностики діабетичної кардіоміопатії
Ехокардіографія
- Bugger H., Abel E.D. Molecular mechanisms of diabetic cardiomyopathy. Diabetologia. 2014. 57(4). 660-71. doi: 10.1007/s00125-014-3171-6.
- Tate M., Grieve D.J., Ritchie R.H. Are targeted therapies for diabetic cardiomyopathy on the horizon? Clin. Sci. (Lond). 2017. 131(10). 897-915. doi: 10.1042/CS20160491.
- Marwick T.H., Ritchie R., Shaw J.E., Kaye D. Implications of underlying mechanisms for the recognition and management of diabetic cardiomyopathy. J. Am. Coll. Cardiol. 2018. 71(3). 339-51. doi: 10.1016/j.jacc.2017.11.019.
- Athithan L., Gulsin G.S., McCann G.P., Levelt E. Diabetic cardiomyopathy: Pathophysiology, theories and evidence to date. World J. Diabetes. 2019. 10(10). 490-510. doi: 10.4239/wjd.v10.i10.490.
- Gulsin G.S., Athithan L., McCann G.P. Diabetic cardiomyopathy: prevalence, determinants and potential treatments. Ther. Adv. Endocrinol. Metab. 2019. 10. 2042018819834869. doi: 2042018819834869.
- Naim A., Pan Q., Baig M.S. Matrix Metalloproteinases (MMPs) in Liver Diseases. J. Clin. Exp. Hepatol. 2017. 7(4). 367-72. doi: 10.1016/j.jceh.2017.09.004.
- Zaslavskaya E.L., Morozov A.N., Ionin V.A., Ma I., Nifontov S.Е., Baranova Е.I. et al. The role of transforming growth factor beta-1 and galectin-3 in formation of the left atrium fibrosis in patients with paroxysmal atrial fibrillation and metabolic syndrome. Russ. J. Cardiol. 2018. 154(2). 60-6. (in Russian). doi: 10.15829/1560-4071-2018-2-60-66.
- Serhiyenko V.A., Serhiyenko A.A. Diabetic cardiac autonomic neuropathy. In: Saldaña J.R., ed. Diabetes Textbook: Clinical Principles, Patient Management and Public Health Issues. Basel: Springer, Cham. Springer Nature Switzerland AG, 2019. 53. 825-850. doi: 10.1007/978-3-030-11815-0.
- Paolillo S., Marsico F., Prastaro M., Renga F., Esposito L., De Martino F. et al. Diabetic cardiomyopathy: definition, diagnosis, and therapeutic implications. Heart Fail. Clin. 2019. 15(3). 341-7. doi: 10.1016/j.hfc.2019.02.003.
- Lee M.M.Y., McMurray J.J.V., Lorenzo-Almoros A., Kristensen S.L., Sattar N., Jhund P.S., Petrie M.C. Diabetic cardiomyopathy. Heart. 2019. 105(4). 337-45. doi: 10.1136/heartjnl-2016-310342.
- Jia G., Hill M.A., Sowers J.R. Diabetic cardiomyopathy: An update of mechanisms contributing to this clinical entity. Circ. Res. 2018. 122(4). 624-38. doi: 10.1161/CIRCRESAHA.117.311586.
- Maack C., Lehrke M., Backs J., Heinzel F.R., Hulot J.S., Marx N. et al. Heart failure and diabetes: metabolic alterations and therapeutic interventions: a state-of-the-art review from the Translational Research Committee of the Heart Failure Association—European Society of Cardiology. Eur. Heart J. 2018. 39(48). 4243-54. doi: 10.1093/eurheartj/ehy596.
- Sun L., Yu M., Zhou T., Zhang S., He G., Wang G., Gang X. Current advances in the study of diabetic cardiomyopathy: From clinicopathological features to molecular therapeutics (Review). Mol. Med. Rep. 2019. 20. 2051-62. doi: 10.3892/mmr.2019.10473.
- Voulgari C., Papadogiannis D., Tentolouris N. Diabetic cardiomyopathy: from the pathophysiology of the cardiac myocytes to current diagnosis and management strategies. Vasc. Health. Risk Manag. 2010. 6. 883-903. doi: 10.2147/VHRM.S11681.
- Qbrezan A.G. Controversial questions: “cardiomyopathy” or “myocardiodystrophy”? Vestnik of St. Petersburg University. 2014. 3. 192-208. (in Russian). http://elibrary.ru/item.asp?id=22255610.
- Lee W.S., Kim J. Diabetic cardiomyopathy: where we are and where we are going. Korean J. Intern. Med. 2017. 32. 404-421. 10.3904/kjim.2016.208
- Tesfaye S., Sloan G. Diabetic polyneuropathy — advances in diagnosis and intervention strategies. Eur. Endocrinol. 2020. 16(1). 15-20. doi: 10.17925/EE.2020.16.1.15.
- Gilca G.E., Stefanescu G., Badulescu O., Tanase D.M., Bararu I., Ciocoiu M. Diabetic cardiomyopathy: current approach and potential diagnostic and therapeutic targets. J. Diabetes Res. 2017. 2017. 1310265. doi: 10.1155/2017/1310265.
- Lorenzo-Almorós A., Tuñón J., Orejas M., Cortes M., Egido J., Lorenzo O. Diagnostic approaches for diabetic cardiomyopathy. Cardiovasc. Diabetol. 2017. 16. 28. doi: 10.1186/s12933-017-0506-x.
- Rawshani A., Rawshani A., Franzén S., Sattar N., Eliasson B., Svensson A.M., Zethelius B., Miftaraj M., McGuire D.K., Rosengren A., Gudbjörnsdottir S. Risk Factors, Mortality, and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N. Engl. J. Med. 2018. 379. 633-644. doi: 10.1056/NEJMoa1800256.
- Dunlay S.M., Givertz M.M., Aguilar D., Allen L.A., Chan M., Desai A.S. et al. Type 2 diabetes mellitus and heart failure: A Scientific Statement from the American Heart Association and the Heart Failure Society of America. Circulation. 2019. 140(7). e294-e324. doi: 10.1161/CIR.0000000000000691.
- Patil V.C., Patil H.V., Shah K.B., Vasani J.D., Shetty P. Diastolic dysfunction in asymptomatic type 2 diabetes mellitus with normal systolic function. J. Cardiovasc. Dis. Res. 2011. 2(4). 213-22. doi: 10.4103/0975-3583.89805.
- Karavaev P.G., Veklich A.S., Koziolova N.A. Cardiovascular remodeling in patients with diabetic сardiomyopathy. Russ. J. Cardiol. 2019. 24(11). 42-7. (in Russian). doi: 10.15829/1560-4071-2019-11-42-47.
- Teupe C., Rosak C. Diabetic cardiomyopathy and diastolic heart failure-difficulties with relaxation. Diabetes Res. Clin. Pract. 2012. 97(2). 185-94. doi: 10.1016/j.diabres.2012.03.008.
- Gu H., Liu Y., Mei S., Wang B., Sun G., Wang X. et al. Left ventricular diastolic dysfunction in nonhuman primate model of dysmetabolism and diabetes. BMC Cardiovasc. Disord. 2015. 15. 141. doi: 10.1186/s12872-015-0133-y.
- Yazıcı D., Ozben B., Yavuz D., Deyneli O., Aydın H., Tarcin O., Akalin S. Epicardial adipose tissue thickness in type 1 diabetic patients. Endocrine. 2011. 40(2). 250-5. doi: 10.1007/s12020-011-9478-x.
- Lima-Martinez M.M., Paoli M., Rodney M., Balladares N., Contreras M., D’Marco L., Iacobellis G. Effect of sitagliptin on epicardial fat thickness in subjects with type 2 diabetes and obesity: a pilotstudy. Endocrine. 2016. 51(3). 448-55. doi: 10.1007/s12020-015-0710-y.
- Seferović P.M., Paulus W.J. Clinical diabetic cardiomyopathy: a two-faced disease with restrictive and dilated phenotypes. Eur. Heart J. 2015. 36(27). 1718a-27c. doi: 10.1093/eurheartj/ehv134.
- Holland D.J., Marwick T.H., Haluska B.A., Leano R., Hordern M.D., Hare J.L. et al. Subclinical LV dysfunction and 10-year outcomes in type 2 diabetes mellitus. Heart. 2015. 101(13). 1061-6. doi: 10.1136/heartjnl-2014-307391.
- Cosyns B., Droogmans S., Hernot S., Degaillier C., Garbar C., Weytjens C. et al. Effect of streptozotocin-induced diabetes on myocardial blood flow reserve assessed by myocardial contrast echocardiography in rats. Cardiovasc. Diabetol. 2008. 7. 26. doi: 10.1186/1475-2840-7-26.
- Tadic M., Celic V., Cuspidi C., Ilic S., Pencic B., Radojkovic J., Ivanovic B. et al. Right heart mechanics in untreated normotensive patients with prediabetes and type 2 diabetes mellitus: a two- and three-dimensional echocardiographic study. J. Am. Soc. Echocardiogr. 2015. 28(3). 317. doi: 10.1016/j.echo.2014.11.017.
- Badano L.P., Boccalini F., Muraru D., Bianco L.D., Peluso D., Bellu R., Zoppellaro G. et al. Current clinical applications of transthoracic three-dimensional echocardiography. J. Cardiovasc. Ultrasound. 2012. 20(1). 1-22. doi: 10.4250/jcu.2012.20.1.1.
- Kobalava Zh.D., Medovchshikov V.V., Yeshniyazov N.B., Khasanova E.R. The modern paradigm of pathophysiology, prevention and treatment of heart failure in type 2 diabetes mellitus. Russ. J. Cardiol. 2019. 24(11). 98-111. (in Russian). doi: 10.15829/1560-4071-2019-11-98-111.
- Koval S.M., Yushko K.O., Snihurska I.O., Starchenko T.G., Pankiv V.I., Lytvynova O.M., Mysnychenko O.V. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial Hypertension (Poland). 2019. 23(3). 183-189. doi: 10.5603/AH.a2019.0012.
- Holly G., Giuseppe C., Haruhiko A., Wilansky S., Carerj S., Gentile F. et al. Assessment of myocardial mechanics using speckle tracking echocardiography: fundamentals and clinical applications. J. Am. Soc. Echocardiogr. 2010. 23(4). 351-69. doi: 10.1016/j.echo.2010.02.015.
- Sitia S., Tomasoni L., Turiel M. Speckle tracking echocardiography: A new approach to myocardial function. World J. Cardiol. 2010. 2(1). 1-5. doi: 10.4330/wjc.v2.i1.1.
- Wu Victor Chien-Chia, Masaaki T., Kyoko O., Haruki N., Yoshitani H., MasahitoT., Abe H. et al. Effect of through-plane and twisting motion on left ventricular strain calculation: direct comparison between two-dimensional and three-dimensional speckle-tracking echocardiography. J. Am. Soc. Echocardiogr. 2013. 26(11). 1274-81. doi: 10.1016/j.echo.2013.07.006.
- Geyer H., Caracciolo G., Abe H., Wilansky S., Carerj S., Gentile F. et al. Assessment of myocardial mechanics using speckle tracking echocardiography: fundamentals and clinical applications. J. Am. Soc. Echocardiogr. 2010. 23(4). 351-69. doi: 10.1016/j.echo.2010.02.015.
- Enomoto M., Ishizu T., Seo Y., Kameda Y., Suzuki H., Shimano H. et al. Myocardial dysfunction identified by three-dimensional speckle tracking echocardiography in type 2 diabetes patients relates to complications of microangiopathy. J. Cardiol. 2016. 68(4). 282-7. doi: 10.1016/j.jjcc.2016.03.007.
- Liu Y.W., Su C.T., Sung J.M., Wang S.P.H., Su Y.R., Yang C.S. et al. Association of left ventricular longitudinal strain with mortality among stable hemodialysis patients with preserved left ventricular ejection fraction. Clin. J. Am. Soc. Nephrol. 2013. 9. 1564-74. doi: 10.2215/CJN.10671012.
- Shepherd D.L., Nichols C.E., Croston T.L., McLaughlin S.L., Petrone A.B., Lewis S.E., Thapa D. et al. Early detection of cardiac dysfunction in the type 1 diabetic heart using speckle-tracking based strain imaging. J. Mol. Cell Cardiol. 2016. 90. 74-83. doi: 10.1016/j.yjmcc.2015.12.001.
- Diamant M., Lamb H.J., Groeneveld Y., Endert E.L., Smit J.W.A., Bax J.J., Romijn J.A. et al. Diastolic dysfunction is associated with altered myocardial metabolism in asymptomatic normotensive patients with well-controlled type 2 diabetes mellitus. J. Am. Coll. Cardiol. 2003. 42(2). 328-35. doi: 10.1016/s0735-1097(03)00625-9.
- Tillquist M.N., Maddox T.M. Update on diabetic cardiomyopathy: inches forward, miles to go. Curr. Diab. Rep. 2012. 12(3). 305-13. doi: 10.1007/s11892-012-0274-7.
- Widya R.L., van der Meer R.W., Smit J.W.A., Rijzewijk L.J., Diamant M., Bax J.J., de Roos A. et al. Right ventricular involvement in diabetic cardiomyopathy. Diabetes Care. 2013. 36(2). 457-62. doi: 10.2337/dc12-0474.
- Daneshvar D., Wei J., Tolstrup K., Thomson L.E.J., Shufelt C., Merz C.N.B. Diastolic dysfunction: improved understanding using emerging imaging techniques. Am. Heart J. 2010. 160(3). 394-404. doi: 10.1016/j.ahj.2010.06.040.
- Pankiv V.I. Efficacy and pathogenetic justification for the use of vildagliptin in patients with type 2 diabetes mellitus. Mìžnarodnij endokrinologìčnij žurnal. 2019. 15(7). 28-33. doi: 10.22141/2224-0721.15.7.2019.186055.
- Matsue Y., Suzuki M., Nakamura R., Abe M., Ono M., Yoshida S., Seya M. et al. Prevalence and prognostic implications of pre-diabetic state in patients with heart failure. Circ. J. 2011. 75(12). 2833-9. doi: 0.1253/circj.cj-11-0754.
- Ernande L., Audureau E., Jellis C.L., Bergerot C., Henegar C., Sawaki D., Czibik G. et al. Clinical implications of echocardiographic phenotypes of patients with diabetes mellitus. J. Am. Coll. Cardiol. 2017. 70(14). 1704-16. doi: 10.1016/j.jacc.2017.07.792.
- Ernande L., Bergerot C., Girerd N., Thibault H., Davidsen E.S., Pignon-Blanc P.G., Amaz C. et al. Longitudinal myocardial strain alteration is associated with left ventricular remodeling in asymptomatic patients with type 2 diabetes mellitus. J. Am. Soc. Echocardiogr. 2014. 27(5). 479-88. doi: 10.1016/j.echo.2014.01.001.
- Kukharenko S.S., Yadrikhinskaya M.N., Shatskaya O.A., Drozdova E.N., Kudryashova А.L., Shestakova M.V., Dedov I.I. Isolated left ventricular diastolic dysfunction in diabetes mellitus: opinions change. Probl. Endocrinol. 2016. 62(6). 10-9. (in Russian). doi: 10.14341/probl201662610-19.
- From A.M., Scott C.G., Chen H.H. The development of heart failure in patients with diabetes mellitus and pre-clinical diastolic dysfunction a population-based study. J. Am. Coll. Cardiol. 2010. 55(4). 300-5. doi: 10.1016/j.jacc.2009.12.003.
- Kadappu K.K., Boyd A., Eshoo S., Haluska B., Yeo A.E.T., Marwick T.H., Thomas L. Changes in left atrial volume in diabetes mellitus: more than diastolic dysfunction? Eur. Heart J. Cardiovasc. Imaging. 2012. 13(12). 1016-23. doi: 10.1093/ehjci/jes084.
- Kusunose K., Kwon D.H., Motoki H., Flamm S.D., Marwick T.H. Comparison of three-dimensional echocardiographic findings to those of magnetic resonance imaging for determination of left ventricular mass in patients with ischemic and nonischemic cardiomyopathy. Am. J. Cardiol. 2013. 112(4). 604-11. doi: 10.1016/j.amjcard.2013.04.028.
- Shimizu I., Minamino T., Toko H., Okada S., Ikeda H., Yasuda N., Tateno K. et al. Excessive cardiac insulin signaling exacerbates systolic dysfunction induced by pressure overload in rodents. J. Clin. Invest. 2010. 120(5). 1506-14. doi: 10.1172/JCI40096.
- Liu J.H., Chen Y., Yuen M., Zhen Z., Chan C.W., Lam K.S., Tse H.F. et al. Incremental prognostic value of global longitudinal strain in patients with type 2 diabetes mellitus. Cardiovasc. Diabetol. 2016. 15. 22. doi: 10.1186/s12933-016-0333-5.
- Goebel B., Gjesdal O., Kottke D., Otto S., Jung C., Lauten A. et al. Detection of irregular patterns of myocardial contraction in patients with hypertensive heart disease: a two-dimensional ultrasound speckle tracking study. J. Hypertens. 2011. 29(11). 2255-64. doi: 10.1097/HJH.0b013e32834bdd09.
- Stanton T., Leano R., Marwick T.H. Prediction of all-cause mortality from global longitudinal speckle strain: comparison with ejection fraction and wall motion scoring. Circ. Cardiovasc. Imaging. 2009. 2(5). 356-64. doi: 10.1161/CIRCIMAGING.109.862334.
- Zoppini G., Bergamini C., Bonapace S., Trombetta M., Mantovani A., Toffalini A., Lanzoni L. et al. Left ventricular chamber dilation and filling pressure may help to categorise patients with type 2 diabetes. BMJ Open Diabetes Res. Care. 2018. 6(1). e000529. doi:10.1136/bmjdrc-2018-000529.
- Dei Cas A., Khan S.S., Butler J., Mentz R.J., Bonow R.O., Avogaro A., Tschoepe D. et al. Impact of diabetes on epidemiology, treatment, and outcomes of patients with heart failure. JACC Heart Fail. 2015. 3(2). 136-45. doi: 10.1016/j.jchf.2014.08.004.
- Trachanas K., Sideris S., Aggeli C., Poulidakis E., Gatzouliz K., Tousoulis D., Kallikazaros I. Diabetic cardiomyopathy: from pathophysiology to treatment. Hellenic J. Cardiol. 2014. 55. 411-21. PMID: 25243440.

/105.jpg)
/107.jpg)