Работа выполнена в рамках плановой научной тематики Государственного учреждения «Институт проблем эндокринной патологии им. В.Я. Данилевского Национальной академии медицинских наук Украины» «Визначення ролі впливу інсулінорезистентності на розвиток новоутворень щитоподібної та надниркових залоз».
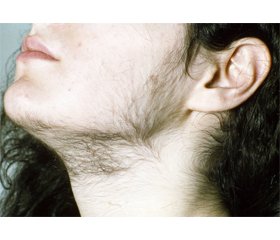
Гиперандрогения (ГА) — патологическое состояние, обусловленное действием избыточной продукции андрогенов на органы и ткани-мишени, является одним из самых распространенных гормональных нарушений, наблюдающимся у 5–20 % женщин репродуктивного возраста в популяции и у 35–41 % женщин, страдающих бесплодием, обусловленным хронической ановуляцией [1]. ГА проявляется совокупностью признаков поражения кожи и ее придатков (себорея, акне, гирсутизм, алопеция) и определяется термином «андрогензависимая дермопатия» [2]. В сочетании с другими манифестированными признаками вирилизации ГА в значительной мере усугубляют социально-психологические, межличностные отношения у большинства пациенток, нередко вызывая тревогу, депрессию, снижение качества жизни. В связи с этим проблема ГА имеет не только медицинское, но и социальное значение.
В апреле 2016 года в журнале «Репродуктивная эндокринология» № 4(30) был опубликован Национальный консенсус по ведению пациенток с гиперандрогенией (2016) (далее — Национальный консенсус) [3]. Для врачей-эндокринологов данная проблема весьма актуальна, подтверждением чего являются описания андрогеннезависимых заболеваний во всех руководствах по клинической эндокринологии, а также многочисленные публикации, посвященные синдрому ГА (СГА) у лиц женского пола, в периодических изданиях эндокринологического профиля [4–7].
Актуальной проблемой, широко изучаемой как эндокринологами, так и гинекологами, является такой клинический вариант синдрома ГА, как синдром поликистозных яичников (СПКЯ). На протяжении нескольких десятилетий термин «СПКЯ» был собирательным понятием, включающим различные по патогенезу заболевания, которые сопровождаются формированием в яичниках морфологических изменений, соответствующих поликистозу. На сегодняшний день изменилась трактовка термина «СПКЯ» и, следовательно, подходы к его диагностике. Так, согласно определению, сформулированному в 1990 году Национальным институтом здоровья США [8], а также в 2003 году согласительным симпозиумом по проблеме СПКЯ в г. Роттердаме [9], СПКЯ остается диагнозом, требующим исключения других известных нарушений, которые проявляются универсальными клиническими признаками ГА, а поэтому могут протекать под маской СПКЯ. Обязательным условием для постановки этого диагноза является отсутствие у пациентки самостоятельного эндокринного заболевания с наличием ГА и хронической ановуляции, т.е. тех нарушений, которые лежат в основе формирования поликистоза яичников (ПКЯ). Данные формы ПКЯ, которые фактически являются вторичными, несмотря на их патогенетическую связь с ГА и хронической ановуляцией и подтверждение по результатам ультразвукового исследования, к СПКЯ не относятся, а рассматриваются в рамках тех заболеваний, которые и обусловливают формирование этой патологии.
Таким образом, с одной стороны, СПКЯ остается синдромом, идентификация которого невозможна и недопустима на основании изолированного наличия любого единственного диагностического критерия, а с другой стороны, простой анализ попарного сочетания современных критериев позволяет сделать принципиальный вывод о необходимости расширенного толкования термина «СПКЯ». К сожалению, данное положение врачами-гинекологами зачастую не принимается во внимание. Это подтверждает факт отсутствия в Национальном консенсусе упоминания об эндокринопатиях, которые сопровождаются вторичным ПКЯ. Такими заболеваниями, наиболее часто встречающимися в клинической практике, являются пубертатно-юношеский диспитуитаризм (ПЮД) и его эквивалент у взрослых — гипоталамо-гипофизарная дисфункция (ГГД), а также неклассическая форма врожденной дисфункции коры надпочечников (НФВДКН). Исключение (или подтверждение) этих заболеваний требует тщательной оценки клинических данных и результатов дополнительных исследований, что врачами-гинекологами проводится не в полном объеме.
В основе ПЮД и ГГД, сопровождающихся вторичным ПКЯ, лежит гиперкортицизм функционального генеза, который клинически проявляется ожирением с розовыми стриями, артериальной гипертензией (АГ), нарушениями толерантности к глюкозе, инсулинорезистентностью (ИР), гирсутизмом и другими симптомами кожного вирилизма, а лабораторно — повышенным содержанием свободного кортизола в суточной моче при повышенном или нормальном уровне кортизола в сыворотке крови в утренние часы и дислипидемией. В пользу функционального гиперкортицизма свидетельствует положительный результат малой пробы с дексаметазоном. В то же же время необходимо учитывать, что отрицательный результат пробы подтверждает эндогенный гиперкортицизм органического генеза и требует обследования пациентки в условиях специализированного эндокринологического стационара.
Необходимо отметить, что органические формы эндогенного гиперкортицизма, какими являются болезнь Иценко — Кушинга и кортизол-секретирующие опухоли коры надпочечников, ранее называемые синдромом Кушинга, обычно манифестируют кушингоидной симптоматикой, а яичники при этом, как правило, подвергаются атрофическим изменениям.
В порядке комментария к представленным в Национальном консенсусе положениям следует указать, что в Украине методы определения свободного кортизола в крови отсутствуют, а пробы с дексаметазоном, являющиеся подавляющими пробами, а не стимуляционными, как указывается в Национальном консенсусе, не рекомендованы с целью разграничения эндогенного и экзогенного гиперкортицизма.
Считаем необходимым остановиться и на положениях Национального консенсуса, касающихся оценки состояния углеводного обмена у пациенток с СПКЯ. Так, в Национальном консенсусе рекомендовано определение уровня гликемии натощак, а затем проведение перорального теста толерантности к глюкозе как скринингового теста для диагностики сахарного диабета (СД) 2-го типа, т.е. даже при нормогликемии натощак, а при невозможности его проведения рекомендовано определение уровня гликозилированного гемоглобина, что противоречит ключевым рекомендациям по диагностике СД 2-го типа.
Лечение больных с ПЮД и ГГД должно быть комплексным, включающим следующие направления: улучшение трофических процессов в клеточных структурах центральной нервной системы, в первую очередь гипоталамуса; устранение гипоксии головного мозга, коррекция АГ; проведение рассасывающей и противовоспалительной терапии; нормализация массы тела; коррекция метаболических нарушений, обусловленных ИР; подавление надпочечникового стероидогенеза; коррекция нарушений менструального цикла и применение антиандрогенов [10].
Препараты, повышающие чувствительность к инсулину (инсулиносенситайзеры), к которым относится метформин и его аналоги, показаны больным с прогрессирующим ожирением независимо от наличия (или отсутствия) нарушений глюкозного гомеостаза. При назначении метформина следует помнить о его феномене потенцировать эффекты кломифена [11, 12].
Среди антиандрогенов наиболее широко используются препараты, содержащие ципротерона ацетат (Диане-35, андрокур). Однако необходимо помнить, что в настоящее время в свете широкого изучения различных аспектов метаболического синдрома (МС) лекарственные препараты оцениваются с позиции их метаболической нейтральности, что особенно важно при назначении стероидных антиандрогенов, каким является ципротерона ацетат, с учетом большой длительности такого лечения. На сегодняшний день можно считать установленным, что терапия стероидными антиандрогенами показана лишь тем пациенткам с СПКЯ, у которых отсутствуют метаболические нарушения, связанные с ИР. Из этого следует, что для многочисленной группы пациенток с ПЮД и ГГД в сочетании с ПКЯ препараты, содержащие ципротерона ацетат, противопоказаны, с учетом его негативного влияния на липидный обмен (повышение уровня триглицеридов и липопротеинов низкой плотности), что усугубляет имеющиеся у больных метаболические нарушения.
Патогенетически обосновано использование верошпирона, периферические антиандрогенные эффекты которого обеспечиваются непосредственным связыванием с рецепторами андрогенов и ингибированием активности в тканях-мишенях фермента 5-α-редуктаза, катализирующего превращение тестостерона в дигидротестостерон [10]. Антиандрогенный эффект верошпирона связан также с подавлением синтеза андрогенов в коре надпочечников и гонадах путем снижения активности микросомальных ферментов, действие которых зависит от цитохрома Р450. К тому же верошпирон подавляет синтез в коре надпочечников кортизола и других глюкокортикоидов и обладает способностью повышать периферическую конверсию тестостерона в эстрогены.
Однако у данной категории больных с ПКЯ верошпирон, используемый как антиандроген, должен быть препаратом выбора, что определяет клинические особенности каждой пациентки; индивидуальной должна быть и доза препарата [13]. Так, у больных со склонностью к метроррагиям и наличием артериальной гипотонии назначение верошпирона нецелесообразно. При незначительной выраженности гирсутизма и проявлений гиперкортицизма показаниями для лечения верошпироном являются внутричерепная и АГ, задержка в организме жидкости. Начальная суточная доза препарата у таких пациенток не должна превышать 100 мг, в дальнейшем возможна коррекция дозы с учетом клинических показателей.
Нестероидные антиандрогены, открытые около 40 лет назад, первоначально использовались исключительно для лечения андрогензависимых заболеваний у мужчин. Их применение у женщин является приоритетом украинской науки. Так, в ГУ «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины» был создан и изучен нестероидный антиандроген флутамид, лишенный антигонадотропной, прогестагенной и эстрогенной активности. Флутамид конкурентно блокирует взаимодействие андрогенов с их клеточными рецепторами и препятствует проявлению биологических эффектов мужских половых гормонов в андрогенчувствительных тканях. Позднее институтом было получено разрешение на его использование в клинической практике в виде таблеток нифтолид для диагностики гипогонадизма и терапии рака предстательной железы у мужчин и мази нифтолид для лечения гирсутизма у женщин. При местном применении мази эффект в виде истончения и просветления волос, облегчения их эпиляции, замедления роста, частичного выпадения проявляется через 2–3 мес.
Обладая рядом преимуществ по сравнению с другими антиандрогенами, флутамид проявляет гепатотоксическое действие в дозах, превышающих 500 мг в сутки [14]. Меньшие дозы препарата (250 мг/сут) выраженных побочных эффектов не вызывают, однако постоянный контроль уровня трансаминаз крови является обязательным.
Как одно из перспективных направлений в лечении андрогензависимых болезней кожи и ее придатков можно рассматривать также местное применение андрогенов. Одним из таких средств является эфлорнитина гидрохлорид (международное торговое название Vaniqa), механизм действия которого связан с угнетением орнитина декарбоксилазы. На фармацевтическом рынке Украины данный препарат не зарегистрирован.
До настоящего времени не определены оптимальные сроки лечения антиандрогенами, необходимые для получения положительного эффекта. Однако мнение многих исследователей сводится к тому, что лечение должно быть длительным, поскольку существует прямая зависимость между продолжительностью приема антиандрогенов и сроками рецидива ГА. С учетом этого, во избежание возможных побочных эффектов, необходима тщательная оценка клинико-гормональных особенностей, определяющих индивидуальный подход к выбору препарата.
Крупномасштабных исследований, посвященных эффективности лечения гирсутизма с помощью антиандрогенов и тератогенным эффектам этих препаратов, не проведено, однако следует учитывать, что при приеме антиандрогенов существует потенциальный риск феминизации плода мужского пола.
Рассматривая перспективы использования антиандрогенов в лечении больных с ПКЯ, необходимо помнить, что эти препараты не устраняют причину болезни. Поэтому независимо от их положительных кожных эффектов и нормализации уровней андрогенов в крови на излечение пациенток с помощью только антиандрогенов рассчитывать нельзя.
Отмечено, что вторичный ПКЯ развивается у больных с ПЮД и ГГД при тех эндокринопатиях, для которых характерно наличие ожирения, ИР и гиперинсулинемии. Именно данные варианты эндокринной патологии с вторичным ПКЯ, которые продолжают традиционно обозначать как СПКЯ, проявляются теми эндокринно-обменными нарушениями, которые составляют патогенетическую основу развития МС. Нельзя не обратить внимание на то, что гипоталамический синдром, течение которого на начальных этапах его развития не осложнилось структурными изменениями яичников поликистозного характера, а также то же самое заболевание с развернутой клинической симптоматикой, включающей формирование вторичного ПКЯ, принято обозначать различными терминами. Так, первый вариант течения заболевания общепринято обозначать термином «гипоталамо-гипофизарная дисфункция», а второй — «СПКЯ». Фактически одно и то же заболевание рассматривается как две самостоятельные нозологические единицы.
Не вызывает сомнения факт существования отдельного самостоятельного заболевания, которое с современных позиций именуется СПКЯ. По мнению авторов публикации, для его обозначения, во избежание терминологической путаницы, могут быть использованы такие термины, как «синдром Штейна — Левенталя» или «синдром первичного ПКЯ». Как отмечено, примерно в половине случаев данного заболевания ожирение отсутствует, а его клиническая симптоматика обусловлена в основном нарушением яичникового стероидогенеза. При этом вопрос о наличии у данной категории пациенток ИР и факторов, приводящих к ее формированию, остается открытым [15]. В то же время имеются убедительные доказательства того, что именно ПЮД и ГГД, которые сопровождаются связанными с функциональным гиперкортицизмом ИР и гиперинсулинемией, могут рассматриваться с позиций принадлежности к МС [16].
Таким образом, необходимо изменение существующей в литературе необоснованной трактовки термина «СПКЯ» и его отождествление с МС. Это обеспечит единые подходы и повышение эффективности исследований, направленных на изучение различных аспектов весьма актуальной проблемы, каковой является МС.
Предположение о том, что многие случаи НФВДКН, осложненные формированием вторичного ПКЯ, врачи-гинекологи относят к СПКЯ, основано на таких фактах. Как следует из положений Национального консенсуса, основными критериями диагностики данного заболевания являются повышение уровня 17-ОН-прогестерона (17-ОНР), снижение уровня кортизола, а в некоторых случаях — гиперпрогестеронемия. При пограничных значениях уровня 17-ОНР рекомендуется проведение теста с внутривенным введением препарата кортикотропина короткого действия 0,25 мг. Диагностически значимым является повышение уровня стимулированного 17-ОНР > 1000 нг/дл (33 нмоль/л).
При повышении уровня дегидроэпиандростерон-сульфата (ДГЭА-с) на границе референтных значений рекомендовано проведение стимуляционной пробы с дексаметазоном (на подавляющий, а не стимулирующий эффект данного препарата указано выше). С учетом того, что НФВДКН и СПКЯ требуют принципиально различных подходов к лечебной тактике, т.е., признавая чрезвычайную важность дифференциальной диагностики этих заболеваний, необходим пересмотр представленных в Национальном консенсусе рекомендаций с позиций клинической эндокринологии. При этом следует обратить внимание на возможные значительные трудности в диагностике, поскольку НФВДКН можно по праву назвать заболеванием, маскирующимся под СПКЯ.
Как известно, повышение уровня 17-ОНР в базальных условиях и увеличенный его прирост в ходе пробы со стимуляцией кортикотропином являются общепризнанными лабораторными маркерами НФВДКН, связанной с дефицитом фермента 21-гидроксилаза (НФВДКН-деф.-21-ОН), а повышенный уровень ДГЭА-с свидетельствует в пользу НФВДКН, связанной с дефицитом 3β-гидроксистероиддегидрогеназы (НФВДКН-деф.-3β-ГСД) [10]. Однако при этом необходимо учитывать следующие положения. Как установлено, гормональные показатели, свойственные больным с НФВДКН, могут частично совпадать с таковыми у здоровых лиц, а их повторяемость является невысокой. Таким образом, повышенный уровень указанных показателей служит подтверждением диагноза, в то время как отсутствие такого повышения не является достаточным основанием для его исключения. Следует отметить и то, что препараты кортикотропина короткого действия на фармацевтическом рынке Украины отсутствуют, а методики с использованием препаратов-депо с целью диагностики НФВДКН не разработаны. Молекулярно-генетические исследования, подтверждающие данный диагноз, еще не получили широкого внедрения в клиническую практику, поэтому положение Национального консенсуса «в определенных случаях для подтверждения этого диагноза могут быть выполнены генетические методы исследования» имеет определенную долю условности. Интерпретация результатов исследования уровня ДГЭА-с в крови требует уточнений с учетом того, что повышение этого гормона характерно не только для андрогенпродуцирующей опухоли коры надпочечников, но и, как отмечалось, для НФВДКН-деф.-3β-ГСД.
Клиническая картина НФВДКН и наблюдаемые при этом гормональные нарушения определяются избытком андрогенов, накапливающихся под влиянием гиперпродукции адренокортикотропного гормона. В связи с незначительным дефицитом ферментов, что отличает это заболевание от классических вариантов врожденной дисфункции коры надпочечников (ВДКН), у больных отсутствуют как клинические проявления, так и лабораторные подтверждения гипокортизолемии. С учетом этого указание в Национальном консенсусе на снижение уровня кортизола требует уточнений.
В гинекологической практике клинические проявления НФВДКН, как правило, остаются вне поля зрения врачей, что нашло свое отражение и в Национальном консенсусе, в котором клиническая симптоматика данного заболевания не представлена. Однако врачам-эндокринологам хорошо известны такие клинические особенности данной категории пациенток, как «неправильный» пубертат (когда у девочки андрогеннезависимое половое оволосение предшествует эстрогеннезависимому увеличению молочных желез), преждевременное половое созревание, ускорение роста в раннем возрасте, ранняя манифестация гирсутизма и других проявлений кожного вирилизма, которые не сочетаются с морфотипическими признаками избытка андрогенов [10].
С целью выявления специфических клинических маркеров НФВДКН среди других эндокринопатий, сопровождающих ПКЯ, в клинике ГУ «Институт проблем эндокринной патологии им. В.Я. Данилевского НАМН Украины» обследовано 349 пациенток, из которых у 79 диагностированы НФВДКН-деф.-21-ОН и НФВДКН-деф.-3β-ГСД, что подтверждено результатами большого комплекса гормональных показателей, определяемых как в базальных условиях, так и в динамике пробы с кортикотропином. Диагноз «НФВДКН» подтвержден также положительными результатами лечения дексаметазоном.
При обследовании пациенток использован генетический подход — соматогенетическое исследование с синдромологическим анализом [17]. К маркерам НФВДКН отнесена триада проявлений соединительнотканной дисплазии, которая представлена арахнодактилией, генерализованной гипермобильностью суставов и гиперэластичностью кожи. Установлена приоритетная роль наследственной патологии соединительной ткани в формировании фенотипа больных с этим заболеванием, что требует пересмотра общепринятых представлений о клинической симптоматике, которую принято связывать исключительно с гиперандрогенией надпочечникового генеза. Указанные выводы согласуются с данными литературы, в которых приведены доказательства наличия у больных с НФВДКН молекулярно-генетических нарушений, ответственных за состояние соединительной ткани, которые проявляются патологическими изменениями кожи, скелета, сердца и сопровождаются формированием симптоматики, свойственной синдрому Элерса — Данлоса [18, 19]. Важным моментом в постановке диагноза будет выявление малых аномалий развития у пациентки и у родственников первой и второй степени родства, а также установление предполагаемых факторов риска развития дисплазии соединительной ткани. Специфические лабораторные тесты отсутствуют. Диагностическую и прогностическую информативность из лабораторных показателей имеют уровень оксипролина или гидроксипролина в моче и крови и определение сульфатированных и суммарных гликозаминогликанов. Следует подчеркнуть, что данные показатели не являются строго специфичными и будут иметь значение в качестве дополнительного диагностического теста, а также для контроля лечения и выбора наиболее адекватной терапии. В комплексное лечение больных с НФВДКН необходимо включать не только глюкокортикоиды, но и средства, обеспечивающие стимуляцию коллагенообразования и коррекцию обменных нарушений, которые обусловлены патологией соединительной ткани [20].
Ограниченный объем представленных дополнений (описаны два наиболее часто встречающихся варианта эндокринопатий, сопровождающихся ПКЯ) объясняется тем, что информация, представленная в Национальном консенсусе, фактически относится только к одному заболеванию — СПКЯ. Однако в рамках СГА необходимо рассматривать и органические его варианты, при которых ПКЯ отсутствует. Таковыми являются андрогенпродуцирующие опухоли яичников и коры надпочечников, стромальный текоматоз яичников, классические формы ВДКН, манифестные варианты эндогенного гиперкортицизма, пролактиномы с симптомокомплексом персистирующей галактореи/аменореи.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.