Международный эндокринологический журнал Том 17, №1, 2021
Вернуться к номеру
Цукровий діабет і хронічний коронарний синдром
Авторы: Сергієнко В.О., Сергієнко О.О.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна.
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Хронічний коронарний синдром (ХКС) характеризується розвитком епізодів ішемії внаслідок дисбалансу між потребами та кровопостачанням міокарда. Зазвичай такі епізоди провокуються фізичними або емоційними навантаженнями чи іншими стресовими ситуаціями, проте можуть виникати й спонтанно. Класичним проявом ішемії міокарда є напади стенокардії. У деяких випадках захворювання певний час може бути безсимптомним і дебютувати одразу гострим коронарним синдромом. ХКС може мати довготривалий доклінічний період на тлі підтвердженого коронарного атеросклерозу. В огляді проведений аналіз літературних джерел, присвячених сучасному стану проблеми цукрового діабету (ЦД) і ХКС. Зокрема, аналізуються питання, пов’язані з особливостями оцінки ризику, основних чинників, що зумовлюють дуже високий ризик атеросклеротичних серцево-судинних захворювань, класифікацією, основними характеристиками ХКС та його особливостями при ЦД, діагностикою ХКС (дозоване фізичне навантаження (велоергометрія, тредміл-тест) або стрес-тести, однофотонна емісійна комп’ютерна томографія, стрес-ехокардіографія; стрес-магнітно-резонансна томографія, позитронно-емісійна томографія із застосуванням радіоактивних маркерів). Аналізуються питання консервативної терапії ХКС на тлі ЦД (призначення антиагрегантів, блокаторів β-адренорецепторів, блокаторів кальцієвих каналів, нітратів, інгібіторів ангіотензинперетворювального ферменту, міокардіальних цитопротекторів, статинів). Лікування пацієнта з поєднанням ЦД і ХКС буде успішним лише в тому випадку, якщо призначено адекватну, безпечну в плані гіпоглікемій і можливих серцево-судинних ризиків цукрознижувальну терапію, з одного боку, і метаболічно нейтральну антиангінальну терапію — з іншого. Без сумніву, необхідно звернути увагу на корекцію факторів ризику ССЗ, АГ і ХСН.
Хронический коронарный синдром (ХКС) характеризуется развитием эпизодов вследствие дисбаланса между потребностями и кровоснабжением миокарда. Обычно такие эпизоды провоцируются физическими или эмоциональными нагрузками или другими стрессовыми ситуациями, однако могут возникать и спонтанно. Классическим проявлением ишемии миокарда являются приступы стенокардии. В некоторых случаях заболевание определенное время может быть бессимптомным и дебютировать сразу острым коронарным синдромом. ХКС может иметь длительный доклинический период на фоне подтвержденного коронарного атеросклероза. В обзоре проведен анализ литературных источников, посвященных современному состоянию проблемы сахарного диабета и хронического коронарного синдрома. В частности, анализируются вопросы, связанные с особенностями оценки риска, основных факторов, обусловливающих очень высокий риск атеросклеротических сердечно-сосудистых заболеваний, классификацией, основными характеристиками хронического коронарного синдрома и его особенностями при сахарном диабете, диагностикой хронического коронарного синдрома (дозированная физическая нагрузка (велоэргометрии, тредмил-тест) или стресс-тесты, однофотонная эмиссионная компьютерная томография, стресс-эхокардиография; стресс-магнитно-резонансная томография, позитронно-эмиссионная томография с применением радиоактивных маркеров). Анализируются вопросы консервативной терапии хронического коронарного синдрома на фоне сахарного диабета (назначение антиагрегантов, блокаторов β-адренорецепторов, блокаторов кальциевых каналов, нитратов, ингибиторов ангиотензинпревращающего фермента, миокардиальных цитопротекторов, статинов.
Chronic coronary syndrome is characterized by the development of episodes of ischemia due to an imbalance between needs and blood supply to the myocardium. Such episodes are usually provoked by physical or emotional stress or other stressful situations, but can also occur spontaneously. Angina attacks are a classic manifestation of myocardial ischemia. In some cases, the disease may be asymptomatic for a while and begin immediately with acute coronary syndrome. Chronic coronary syndrome may have a long preclinical period on the background of confirmed coronary atherosclerosis. This review analyses the relevant data about the current state of the problem of diabetes mellitus and chronic coronary syndrome. In particular, the issues related to the peculiarities of risk assessment, the main factors causing a very high risk of atherosclerotic cardiovascular diseases; classification, the main characteristics of chronic coronary syndrome and its features in diabetes mellitus; diagnosis of chronic coronary syndrome (dosed physical activity — bicycle ergometry, treadmill test, or stress tests; single-photon emission computed tomography, stress echocardiography; stress cardiac magnetic resonance imaging, positron emission tomography using radioactive tracers) were considered. Features of conservative therapy for chronic coronary syndrome against the background of diabetes mellitus (prescription of antiplatelet agents, β-adrenergic receptor blockers, calcium channel blockers, nitrates, angiotensin-converting enzyme inhibitors, myocardial cytoprotectors, statins) were analyzed. Treatment of a patient with a combination of diabetes mellitus and chronic coronary syndrome will be successful only if adequate antidiabetic therapy that is safe in terms of hypoglycemia and possible cardiovascular risks, on the one hand, and metabolically neutral antianginal therapy, on the other, is prescribed. Undoubtedly, it is necessary to pay attention to the correction of risk factors for cardiovascular diseases, hypertension and chronic heart failure.
цукровий діабет; хронічний коронарний синдром; огляд
сахарный диабет; хронический коронарный синдром; обзор
diabetes mellitus; chronic coronary syndrome; review
Оцінка ризику АССЗ у хворих на ЦД
Хронічний коронарний синдром
Класифікація «німої» (безбольової) ішемії міокарда (ББІМ) [18]
Діагностика
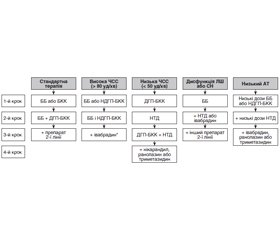
Лікування
Дієта
Основні принципи лікування ХКС [8]
- IDF Diabetes Atlas (International Diabetes Federation website). 2020. Available at: https://www.idf.org/e-library/epidemiology-research/diabetes-atlas/134-idf-diabetes-atlas-8th-edition.html. Accessed 06/28/2020.
- American Diabetes Association. 10. Cardiovascular disease and risk management: standards of medical care in diabetes 2019. Diabetes Care. 2019. 42(Suppl. 1). S103-S23. doi: 10.2337/dc19S010.
- Coutiño-Castelán D., Abundes-Velasco A., de los Santos F.D. et al. Diabetes and Cardiovascular Disease. In: Saldaña J.R., editor. Diabetes Textbook: Clinical Principles, Patient Management and Public Health Issues. Basel: Springer Nature Switzerland AG, 2019. Section 53. 709-30. doi: 10.1007/978-3-030-11815-0_46.
- Serhiyenko V.A., Serhiyenko A.A. Diabetic cardiac autonomic neuropathy. In: Saldaña J.R., ed. Diabetes Textbook: Clinical Principles, Patient Management and Public Health Issues. Basel: Springer, Cham. Springer Nature Switzerland AG. 2019, Section 53. 825-850 p. doi: 10.1007/978-3-030-11815-0.
- Eckel R.H., Jakicic J.M., Ard J.D. et al. American College of Cardiology/American Heart Association Task Force on Practice Guidelines. 2013 AHA/ACC guideline on lifestyle management to reduce cardiovascular risk: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014. 129(25 Suppl. 2). S76-99. doi: 10.1161/01.cir.0000437740.48606.d1.
- Orringer C.E., Jacobson T.A., Maki K.C. NLA scientific statement on the use of icosapent ethyl in statin-treated patients with elevated triglycerides and high or very high ASCVD risk (National Lipid Association website). 2019. Available at: https://www.lipid.org/nla/nla-scientific-statement-use-icosapent-ethyl-statin-treated-patients-elevated-triglycerides-and. Accessed 06/28/2020. doi: 10.1016/j.jacl.2019.10.014.
- American Heart Association. ASCVD Risk Calculator. Available at: https://professional.heart.org/professional/GuidelinesStatements/ASCVDRiskCalculator/UCM_457698_ASCVD-Risk-Calculator.jsp. Accessed October 16, 2018. 43.
- Grundy S.M., Stone N.J., Bailey A.L. et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the management of blood cholesterol: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J. Am. Coll. Cardiol. 2019. 73(24). 3168-209. doi: 10.1016/j.jacc.2018.11.002.
- Knuuti J., Wijns W., Saraste A. et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). Eur. Heart J. 2020. 41(3). 407-77. doi: 10.1093/eurheartj/ehz425.
- Lloyd-Jones D.M., Braun L.T., Ndumele C.E., Smith S.C., Sperling L.S., Virani S.S. Use of risk assessment tools to guide decision-making in the primary prevention of atherosclerotic cardiovascular disease: a special report from the American Heart Association and American College of Cardiology. J. Am. Coll. Cardiol. 2019. 73(24). 3153-67. doi: 10.1016/j.jacc.2018.11.005.
- Agrawal S., Mehta P.K., Bairey Merz C.N. Cardiac syndrome X: update. Heart Fail. Clin. 2016. 12(1). 141-56. doi: 10.1016/j.hfc.2015.08.012.
- Liu A., Wijesurendra R.S., Liu J.M. et al. Diagnosis of microvascular angina using cardiac magnetic resonance. J. Am. Coll. Cardiol. 2018. 71(9). 969-79. doi: 10.1016/j.jacc.2017.12.046.
- Villano A., Lanza G.A., Crea F. Microvascular angina: prevalence, pathophysiology and therapy. J. Cardiovasc. Med. (Hagerstown). 2018. 19(Suppl. 1). e36-9. doi: 10.2459/JCM.0000000000000638.
- Cekirdekci E.I., Bugan B. Level of anxiety and depression in cardiac syndrome X. Med. Princ. Pract. 2019. 28. 82-6. doi: 10.1159/000495109.
- Campeau L. Letter: grading of angina pectoris. Circulation. 1976. 54(3). 522-3. PMID: 947585.
- Verbovoy A.F., Pashentseva A.V., Verbovaya N.I. Diabetic macroangiopathy. Ther. Arch. 2019. 91(10). 139-43. doi: 10.26442/00403660.2019.10.000109. (In Russian).
- Montalescot G., Sechtem U., Achenbach S. et al. 2013 ESC guidelines on the management of stable coronary artery disease: The Task Force on the management of stable coronary artery disease of the European Society of Cardiology. Eur. Heart J. 2013. 34(38). 2949-3003. doi: 10.1093/eurheartj/eht296.
- Cohn P.F. Silent myocardial ischemia: recent developments. Curr. Atheroscler. Rep. 2005. 7. 155-63. doi: 10.1007/s11883-005-0039-8.
- Albus C., Barkhausen J., Fleck E., Haasenritter J., Lindner O., Silber S. The diagnosis of chronic coronary heart disease. Dtsch. Ärztebl. Int. 2017. 114(42). 712-9. doi: 10.3238/arztebl.2017.0712.
- Su G., Mi S., Tao H. et al. Association of glycemic variability and the presence and severity of coronary artery disease in patients with type 2 diabetes. Cardiovasc. Diabetol. 2011. 10. 19. doi: 10.1186/1475-2840-10-19.
- De Lemos J., Torbjørn Omland T. Chronic coronary artery disease: A companion to Braunwald’s Heart Disease. 10th еdition. Elsevier, 2018.
- Aronson D., Edelman E.R. Coronary artery disease and diabetes mellitus. Cardiol. Clin. 2014. 32(3). 439-55. doi: 10.1016/j.ccl.2014.04.001.
- Arnold S.V., Bhatt D.L., Barsness G.W. et al. Clinical management of stable coronary artery disease in patients with type 2 diabetes mellitus: a scientific statement from the American Heart Association. Circulation. 2020. 141(19). e779-e806. doi: 10.1161/CIR.0000000000000766.
- Dădârlat A., Zdrenghea D., Pop D. Role of Duke treadmill score in the diagnosis of ischemic heart disease in women. Rom. J. Intern. Med. 2015. 53(2). 146-52. doi: 10.1515/rjim-2015-0020.
- Salokari E., Laukkanen J.A., Lehtimaki T. et al. The Duke treadmill score with bicycle ergometer: Exercise capacity is the most important predictor of cardiovascular mortality. Eur. J. Prev. Cardiol. 2019. 26(2). 199-207. doi: 10.1177/2047487318804618.
- Lohrke J., Frenzel T., Endrikat J. et al. 25 Years of Contrast-Enhanced MRI: Developments, Current Challenges and Future Perspectives. Adv. Ther. 2016. 33(1). 1-28. doi: 10.1007/s12325-015-0275-4.
- Schofield J.D., Liu Y., Rao-Balakrishna P., Malik R.A., Soran H. Diabetes dyslipidemia. Diabetes Ther. 2016. 7. 203-19. doi: 10.1007/s13300-016-0167-x.
- Jellinger P.S., Handelsman Y., Rosenblit P.D. et al. American Association of Clinical Endocrinologists and American College of Endocrinology Guidelines for management of dyslipidemia and prevention of cardiovascular disease. Endocr. Pract. 2017. 23(Suppl. 2). 1-87. doi: 10.4158/EP171764.APPGL.
- Whelton P.K., Carey R.M., Aronow W.S. et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018. 71(6). 1269-324. doi: 10.1161/HYP.0000000000000066.
- Serhiyenko V.A., Serhiyenko L.M., Serhiyenko A.A. Omega-3 polyunsaturated fatty acids in the treatment of diabetic cardiovascular autonomic neuropathy: A review. In: Moore S.J., editor. Omega-3: Dietary sources, biochemistry and impact on human health. New York: Nova Science Publishers; 2017. Chapter 3. 79-154. Available from: https://novapublishers.com/shop/omega-3-dietary-sources-biochemistry-and-impact-on-human-health/.
- Kones R., Howell S., Rumana U. n-3 polyunsaturated fatty acids and cardiovascular disease: principles, practices, pitfalls, and promises — A contemporary review. Med. Princ. Pract. 2017. 26. 497-508. doi: 10.1159/000485837.
- Abdelhamid A.S., Brown T.J., Brainard J.S. et al. Omega-3 fatty acids for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst. Rev. 2018. 11. Art. No.: CD003177. doi: 10.1002/14651858.CD003177.pub4.
- Bоwman L., Mafham M., Wallendszus K. et al.; The ASCEND Study Collaborative Group. Effects of fatty acid supplements in diabetes mellitus. N. Engl. J. Med. 2018. 379(16). 1540-50. doi: 10.1056/NEJMoa1804989.
- Bernasconi A.A., Wiest M.M., Lavie C.J., Milani R.V., Laukkanen J.A. Effect of omega-3 dosage on cardiovascular outcomes. An updated meta-analysis and meta-regression of interventional trials effect of omega-3 dosage on cardiovascular outcomes. Mayo Clin. Proc. 2020. 95(9). 1-10. doi: 10.1016/j.mayocp.2020.08.034.
- Gyberg V., De Bacquer D., Kotseva K. et al.; EUROASPIRE IV Investigators. Screening for dysglycaemia in patients with coronary artery disease as reflected by fasting glucose, oral glucose tolerance test, and HbA1c: a report from EUROASPIRE IV-a survey from the European Society of Cardiology. Eur. Heart J. 2015. 36(19). 1171-7. doi: 10.1093/eurheartj/ehv008.
- Holman R.R., Paul S.K., Bethel M.A., Matthews D.R., Neil H.A. 10-year follow-up of intensive glucose control in type 2 diabetes. N. Engl. J. Med. 2008. 359(15). 1577-89. doi: 10.1056/NEJMoa0806470.
- American Diabetes Association. Standards of Medical Care in Diabetes-2017 Abridged for Primary Care Providers. Clin. Diabetes. 2017. 35(1). 5-26. doi: 10.2337/cd16-0067.
- Birkeland K.I., Jørgensen M.E., Carstensen B. et al. Cardiovascular mortality and morbidity in patients with type 2 diabetes following initiation of sodium-glucose co-transporter-2 inhibitors versus other glucose-lowering drugs (CVD-REAL Nordic): a multinational observational analysis. Lancet Diabetes Endocrinol. 2017. 5(9). 709-17. doi: 10.1016/S2213-8587(17)30258-9.
- Ormazabal V., Nair S., Elfeky O., Aguayo C., Salomon C., Zuniga F.A. Association between insulin resistance and the development of cardiovascular disease. Cardiovasc. Diabetol. 2018. 17. 122. doi: 10.1186/s12933-018-0762-4.
- Windecker S., Kolh P., Alfonso F. et al. 2014 ESC/EACTS Guidelines on myocardial revascularization: The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI). Eur. Heart J. 2014. 35(37). 2541-619. doi: 10.1093/eurheartj/ehu278.
- Angiolillo D.J., Baber U., Mehran R. Ticagrelor monotherapy in patients with diabetes mellitus undergoing percutaneous coronary interventions: insights from the TWILIGHT trial. Cardiovasc. Res. 2020. 116. e70-e2. doi: 10.1093/cvr/cvaa120.
- Belsey J., Savelieva I., Mugelli A., Camm A.J. Relative efficacy of antianginal drugs used as add-on therapy in patients with stable angina: a systematic review and meta-analysis. Eur. J. Prev. Cardiol. 2015. 22(7). 837-48. doi: 10.1177/2047487314533217.
- Askari I.V. Features of pharmacotherapy β1-adrenoblocker with activation of endothelial nitric oxide nebivolol in patients with coronary heart disease on the background of chronic heart failure (review of literature). Scientific statements of Belgorod State University. Series: Medicine. Pharmacy. 2018. 41(4). 528-38. doi: 10.18413/2075-4728-2018-41-4-528-538. (In Russian).
- Petrie J.R., Guzik T.J., Touyz R.M. Diabetes, hypertension, and cardiovascular disease: clinical insights and vascular mechanisms. Can. J. Cardiol. 2018. 34. 575-84. doi: 10.1016/j.cjca.2017.12.005.
- Koval S.M., Yushko K.O., Snihurska I.O., Starchenko T.G., Pankiv V.I., Lytvynova O.M., Mysnychenko O.V. Relations of angiotensin-(1-7) with hemodynamic and cardiac structural and functional parameters in patients with hypertension and type 2 diabetes. Arterial. Hypertension 2019. 23(3). 183-189. doi: 10.5603/AH.a2019.0012.
- França-Silva M.S., Balarini C.M., Cruz J.C., Khan B.A., Rampelotto P.H., Braga V.A. Organic nitrates: past, present and future. Molecules. 2014. 19(9). 15314-23. doi: 10.3390/molecules190915314.
- Boden W.E., Padala S.K., Cabral K.P., Buschmann I.R., Sidhu M.S. Role of short-acting nitroglycerin in the management of ischemic heart disease. Drug Des. Devel. Ther. 2015. 9. 4793-805. doi: 10.2147/DDDT.S79116.
- Tarkin J.M., Kaski J.C. Nicorandil and long-acting nitrates: vasodilator therapies for the management of chronic stable angina pectoris. Eur. Cardiol. 2018. 13(1). 23-88. doi: 10.15420/ecr.2018.9.2.
- Sirenko Yu.M., Torbas O.O. Modern symptomatic therapy for stable angina pectoris: what to choose? Arterial. Hypertension. 2019. 3-4(65-66). 20-30. doi: 10.22141/2224-1485.3-4.64-65.2019.177844. (In Ukrainian).
- Rosendorff C., Lackland D.T., Allison M. et al.; American Heart Association; American College of Cardiology; American Society of Hypertension. Treatment of hypertension in patients with coronary artery disease: A scientific statement from the American Heart Association, American College of Cardiology, and American Society of Hypertension. J. Am. Coll. Cardiol. 2015. 65(18). 1998-2038. doi: 10.1016/j.jacc.2015.02.038.
- Mehul A., Pragani M.A., Desai K.P. et al. The role of nitrates in the management of stable ischemic heart disease: A review of the current evidence and guidelines. Rev. Cardiovasc. Med. 2017. 18(1). 14-20. doi: 10.3909/ricm0857.
- Grodzinsky A., Arnold S.V., Jacob D., Draznin B., Kosiborod M. The impact of cardiovascular drugs on glycemic control: A review. Endocr. Pract. 2017. 23(3). 363-71. doi: 10.4158/EP161309.RA.
- Lehrke L., Marx N. Diabetes mellitus and heart failure. Am. J. Med. 2017. 130. S40-S50. doi: 10.1016/j.amjmed.2017.04.010.
- Bangalore S., Fakheri R., Toklu B., Messerli F. Diabetes mellitus as a compelling indication for use of renin angiotensin system blockers: systematic review and meta-analysis of randomized trials. BMJ. 2016. 352. i438. doi: 10.1136/bmj.i438.
- Cho Y.R., Ann S.H., Won K.B. et al. Association between insulin resistance, hyperglycemia, and coronary artery disease according to the presence of diabetes. Sci. Rep. 2019. 9(1). 6129. doi: 10.1038/s41598-019-42700-1.
- Bhatt D.L., Steg P.G., Miller M. et al.; REDUCE-IT Investigators. Effects of Icosapent Ethyl on total ischemic events: From REDUCE-IT. J. Am. Coll. Cardiol. 2019. 73(22). 2791-802. doi: 10.1016/j.jacc.2019.02.032.
- Giugliano R.P., Wiviott S.D., Blazing M.A. et al. Long-term safety and efficacy of achieving very low levels of low-density lipoprotein cholesterol: A prespecified analysis of the IMPROVE-IT Trial. JAMA Cardiol. 2017. 2(5). 547-55. doi: 10.1001/jamacardio.2017.0083.
- Giugliano R.P., Pedersen T.R., Saver J.L. et al.; FOURIER Investigators. Stroke Prevention With the PCSK9 (Proprotein Convertase Subtilisin-Kexin Type 9) Inhibitor Evolocumab Added to Statin in High-Risk Patients With Stable Atherosclerosis. Stroke. 2020. 51(5). 1546-54. doi: 10.1161/STROKEAHA.119.027759.
- Wójcik C. Incorporation of PCSK9 inhibitors into prevention of atherosclerotic cardiovascular disease. Postgrad. Med. 2017. 129(8). 801-10. doi: 10.1080/00325481.2017.1376570.
- Schwartz G.G., Steg P.G., Szarek M. et al.; for the ODYSSEY OUTCOMES Committees and Investigators Alirocumab and Cardiovascular Outcomes after Acute Coronary Syndrome. N. Engl. J. Med. 2018. 379. 2097-107. doi: 10.1056/NEJMoa1801174.

/63.jpg)
/64.jpg)
/65.jpg)
/68.jpg)
/71.jpg)