Международный эндокринологический журнал Том 17, №1, 2021
Вернуться к номеру
Гінекомастія — сучасні уявлення й підходи до лікування
Авторы: Зайцев М.А.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
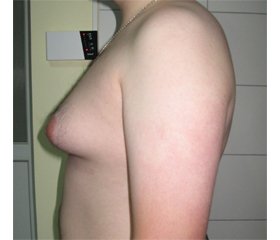
Огляд літератури присвячений доброякісному розростанню залозистої тканини грудної залози у чоловіків. Поширеність гінекомастії досягає 32–65 % залежно від віку та критеріїв, що використовуються для визначення. Гінекомастія у дитячому віці та впродовж періоду статевого дозрівання розглядається як доброякісний стан, який у більшості випадків минає спонтанно. Гінекомастія в дорослому віці частіше трапляється серед людей похилого віку, і при цільовому обстеженні можна виявити основну патологію в 45–50 % випадків. На сьогодні більшість причин гінекомастії залишаються не з’ясованими й обговорюються на рівні гіпотез. Тканина молочних залоз закладається однаково незалежно від статі дитини. Розвиток молочних залоз залежить від андроген-естрогенного співвідношення (АЕС). При переважанні в пубертатному періоді естрогенів і низькій активності андрогенів розвиток і диференціювання тканини молочних залоз здійснюється за жіночим типом. При зворотному АЕС тканина грудних залоз не розвивається. Необхідно враховувати можливість ендокринного або системного захворювання. Зазвичай достатньо визначити базальні рівні тестостерону, естрадіолу, лютеїнізуючого й фолікулостимулюючого гормонів. При простій підлітковій гінекомастії будь-які постійні гормональні зрушення відсутні. Важливо оцінити ступінь загальної андрогенізації пацієнта. Лабораторні дослідження (клініко-біохімічні, гормональні) повинні відповідати конкретному клінічному стану кожного пацієнта. Ефективність терапевтичного лікування гінекомастії у пацієнтів без явних ендокринних розладів із застосуванням гормональних засобів (тестостерон, дигідротестостерон), а також тамоксифену, даназолу, кломіфену слід вважати недоведеною. Хірургічне лікування рекомендується лише для пацієнтів з тривалою гінекомастією, яка не регресує спонтанно або після медикаментозної терапії. Обсяг і тип операції залежать від розміру збільшення грудей та кількості жирової тканини.
Обзор литературы посвящен доброкачественному разрастанию железистой ткани молочной железы у мужчин. Распространенность гинекомастии достигает 32–65 % в зависимости от возраста и критериев, используемых для определения. Гинекомастия в детском возрасте и в течение периода полового созревания рассматривается как доброкачественное состояние, которое в большинстве случаев проходит спонтанно. Гинекомастия во взрослом возрасте чаще встречается среди пожилых людей, и при целевом обследовании можно выявить основную патологию в 45–50 % случаев. На сегодняшний день большинство причин гинекомастии остаются не выясненными и обсуждаются на уровне гипотез. Ткань молочных желез закладывается одинаково независимо от пола ребенка. Развитие молочных желез зависит от андроген-эстрогенного соотношения (АЭС). При преобладании в пубертатном периоде эстрогенов и низкой активности андрогенов развитие и дифференцировка ткани молочных желез осуществляется по женскому типу. При обратном АЭС ткань молочных желез не развивается. Необходимо учитывать возможность эндокринного или системного заболевания. Обычно достаточно определить базальные уровни тестостерона, эстрадиола, лютеинизирующего и фолликулостимулирующего гормонов. При подростковой гинекомастии любые постоянные гормональные сдвиги отсутствуют. Важно оценить степень общей андрогенизации пациента. Лабораторные исследования (клинико-биохимические, гормональные) должны соответствовать конкретному клиническому состоянию каждого пациента. Эффективность терапевтического лечения гинекомастии у пациентов без явных эндокринных расстройств с применением гормональных средств (тестостерон, дигидротестостерон), а также тамоксифена, даназола, кломифена следует считать недоказанной. Хирургическое лечение рекомендуется только для пациентов с длительной гинекомастией, которая не регрессирует спонтанно или после медикаментозной терапии. Объем и тип операции зависят от размера увеличения груди и количества жировой ткани.
A literature review is devoted to the benign growth of glandular tissue of the breast in men. The prevalence of gynecomastia reaches 32–65 % depending on age and the criteria used to determine. Gynecomastia in childhood and during puberty is considered a benign condition, which in most cases passes spontaneously. Gynecomastia in adulthood is more common in the elderly, and targeted examination can reveal the underlying pathology in 45–50 % of cases. Today, most causes of gynecomastia remain unclear and are discussed at the hypothesis level. The tissue of the mammary glands is laid equally regardless of the sex of a child. The development of the mammary glands depends on the androgen-estrogen ratio (AER). With the predominance of estrogens during puberty and low androgen activity, the breast tissue develops and differentiates by the female type. At the return AER, breast tissue does not develop. The possibility of endocrine or systemic disease should be considered. It is usually sufficient to determine basal levels of testosterone, estradiol, luteinizing hormone, and follicle-stimulating hormone. With simple adolescent gynecomastia, there are no permanent hormonal changes. It is important to assess the degree of overall androgenization of the patient. Laboratory tests (clinical, biochemical, hormonal) should correspond to the specific clinical condition of each patient. The effectiveness of therapeutic treatment of gynecomastia in patients without obvious endocrine disorders with the use of hormonal drugs (testosterone, dihydrotestosterone) as well as tamoxifen, danazol, clomiphene should be considered unproven. Surgical treatment is recommended only for patients with prolonged gynecomastia, which does not regress spontaneously or after drug therapy. The extent and type of surgery depend on the size of the breast augmentation and the amount of adipose tissue.
гінекомастія; діагностика; лікування
гинекомастия; диагностика; лечение
gynecomastia; diagnosis; treatment
Висновки
- Kanakis G.A., Nordkap L., Bang A.K., Calogero A.E., Bártfai G., Corona G., Forti G., Toppari J., Goulis D.G., Jørgensen N. EAA clinical practice guidelines-gynecomastia evaluation and management. Andrology. 2019. 7(6). 778-793. doi: 10.1111/andr.12636.
- Akgül S., Kanbur N., Derman O. Pubertal gynecomastia: what about the remaining 10 %? J. Pediatr. Endocrinol. Metab. 2014. 27(9–10). 1027-8. doi: 10.1515/jpem-2014-0017.
- Alesini D., Iacovelli R., Palazzo A., Altavilla A., Risi E., Urbano F., Manai C. et al. Multimodality treatment of gynecomastia in patients receiving antiandrogen therapy for prostate cancer in the era of abiraterone acetate and new antiandrogen molecules. Oncology. 2013. 84(2). 92-9. doi: 10.1159/000343821.
- Bhasin S., Cunningham G.R., Hayes F.J., Matsumoto A.M., Snyder P.J., Swerdloff R.S., Montori V.M.; Task Force, Endocrine Society. Testosterone therapy in men with androgen deficiency syndromes: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2010. 95(6). 2536-59. doi: 10.1210/jc.2009-2354.
- Beltsevich D.G., Kuznetsov N.S., Vanushko V.E., Kalinchenko S.Yu. Gynecomastia. Endocrine Surgery. 2008. 1(2). 25-27 (in Russian).
- Fagerlund A., Lewin R., Rufolo G., Elander A., Santanelli di Pompeo F., Selvaggi G. Gynecomastia: A systematic review. J. Plast. Surg. Hand Surg. 2015. 49(6). 311-8. doi: 10.3109/2000656X.2015.1053398.
- Narula H.S., Carlson H.E. Gynaecomastia — pathophysiology, diagnosis and treatment. Nat. Rev. Endocrinol. 2014. 10(11). 684-98. doi: 10.1038/nrendo.2014.139.
- Chau A., Jafarian N., Rosa M. Male Breast: Clinical and Imaging Evaluations of Benign and Malignant Entities with Histologic Correlation. Am. J. Med. 2016. 129(8). 776-91. doi: 10.1016/j.amjmed.2016.01.009.
- De Barros A.C.S.D., Sampaio M.D.C.M. Gynecomastia: physiopathology, evaluation and treatment. Sao Paulo Med. J. 2012. 130. 187-197. doi: 10.1590/S1516-31802012000300009.
- Gottlieb B., Beitel L.K., Nadarajah A., Paliouras M., Trifiro M. The androgen receptor gene mutations database: 2012 update. Hum. Mutat. 2012. 33(5). 887-94. doi: 10.1002/humu.22046.
- Grigg J., Worsley R., Thew C., Gurvich C., Thomas N., Kulkarni J. Antipsychotic-induced hyperprolactinemia: synthesis of world-wide guidelines and integrated recommendations for assessment, management and future research. Psychopharmacology (Berl.). 2017. 234(22). 3279-3297. doi: 10.1007/s00213-017-4730-6.
- Gudin J.A., Laitman A., Nalamachu S. Opioid Related Endocrinopathy. Pain Med. 2015. 16(Suppl. 1). S9-15. doi: 10.1111/pme.12926.
- Handelsman D.J., Newman J.D., Jimenez M., McLachlan R., Sartorius G., Jones G.R. Performance of direct estradiol immunoassays with human male serum samples. Clin. Chem. 2014. 60(3). 510-7. doi: 10.1373/clinchem.2013.213363.
- Hellmann P., Christiansen P., Johannsen T.H., Main K.M., Duno M., Juul A. Male patients with partial androgen insensitivity syndrome: a longitudinal follow-up of growth, reproductive hormones and the development of gynaecomastia. Arch. Dis. Child. 2012. 97(5). 403-9. doi: 10.1136/archdischild-2011-300584.
- Huhtaniemi I.T., Tajar A., Lee D.M., O’Neill T.W., Finn J.D., Bartfai G., Boonen S. et al.; EMAS Group. Comparison of serum testosterone and estradiol measurements in 3174 European men using platform immunoassay and mass spectrometry; relevance for the diagnostics in aging men. Eur. J. Endocrinol. 2012. 166(6). 983-91. doi: 10.1530/EJE-11-1051.
- Iglesias P., Carrero J.J., Díez J.J. Gonadal dysfunction in men with chronic kidney disease: clinical features, prognostic implications and therapeutic options. J. Nephrol. 2012. 25(1). 31-42. doi: 10.5301/JN.2011.8481.
- James R., Ahmed F., Cunnick G. The efficacy of tamoxifen in the treatment of primary gynecomastia: an observational study of tamoxifen versus observation alone. Breast J. 2012. 18(6). 620-1. doi: 10.1111/tbj.12033.
- Jayasinghe Y., Cha R., Horn-Ommen J., O’Brien P., Simmons P.S. Establishment of normative data for the amount of breast tissue present in healthy children up to two years of age. J. Pediatr. Adolesc. Gynecol. 2010. 23(5). 305-11. doi: 10.1016/j.jpag.2010.03.002.
- Kasielska A., Antoszewski B. Effect of operative treatment on psychosocial problems of men with gynaecomastia. Pol. Przegl. Chir. 2011. 83(11). 614-21. doi: 10.2478/v10035-011-0097-2.
- Kilic M., Kanbur N., Derman O., Akgül S., Kutluk T. The relationship between pubertal gynecomastia, prostate specific antigen, free androgen index, SHBG and sex steroids. J. Pediatr. Endocrinol. Metab. 2011. 24(1–2). 61-7. doi: 10.1515/jpem.2011.112.
- Kinsella C., Landfair A., Rottgers S.A., Cray J.J., Weidman C., Deleyiannis F.W.-B., Grunwaldt L., Losee J.E. The psychological burden of idiopathic adolescent gynecomastia. Plast. Reconstr. Surg. 2012. 129. 1-7. DOI: 10.1097/PRS.0b013e3182361efd.
- Krause W. Drug-inducing gynaecomastia — a critical review. Andrologia. 2012. 44(Suppl. 1). 621-6. doi: 10.1111/j.1439-0272.2011.01240.x.
- Nuttall F.Q., Warrier R.S., Gannon M.C. Gynecomastia and drugs: a critical evaluation of the literature. Eur. J. Clin. Pharmacol. 2015. 71. 569-578. Doi: 10.1007/s00228-015-1835-x.
- Ahmed M., Kanji A., Begum T. Gynaecomastia: an unusual presenting symptom of bladder cancer. BMJ Case Reports. 2015. Doi: 10.1136/bcr-2015-210649.
- Mieritz M.G., Rakêt L.L., Hagen C.P., Nielsen J.E., Talman M.-L.M., Petersen J.H., Sommer S.H. et al. A longitudinal study of growth, sex steroids, and IGF-1 in boys with physiological gynecomastia. J. Clin. Endocrinol. Metab. 2015. 100. 3752-3759. Doi: 10.1210/jc.2015-2836.
- Hatton C.K., Green G.A., Ambrose P.J. Performance-enhancing drugs: understanding the risks. Physical Medicine and Rehabilitation Clinics of North America. 2014. 25. 897-913. DOI: 10.1016/j.pmr.2014.06.013.
- Bowers S.P., Pearlman N.W., McIntyre R.C., Finlayson C.A., Huerd S. Cost-effective management of gynecomastia. Am. J. Surg. 1998. 176. 638-641. Doi: 10.1016/S0002-9610(98)00281-5.
- Søeborg T., Frederiksen H., Fruekilde P., Johannsen T.H., Juul A., Andersson A.M. Serum concentrations of DHEA, DHEAS, 17α-hydroxyprogesterone, Δ4-androstenedione and testosterone in children determined by TurboFlow-LC-MS/MS. Clinica Chimica Acta. 2013. 419. 95-101. Doi: 10.1016/j.cca.2013.01.019.
- Kaptanis S., Parvanta L., Beltran L. Testicular seminoma presenting as unilateral gynecomastia. Breast Journal. 2014. 20. 424-426. Doi: 10.1111/tbj.12287.
- Nieschlag E., Vorona E. Mechanisms in endocrinology: medical consequences of doping with anabolic androgenic steroids: effects on reproductive functions. European Journal of Endocrinology. 2015. 173. 47-58. Doi: 10.1530/EJE-15-0080.
- Deepinder F., Braunstein G.D. Drug-induced gynecomastia: an evidence-based review. Expert Opinion on Drug Safety. 2012. 11. 779-795. doi: 10.1517/14740338.2012.712109.
- Bowman J.D., Kim H., Bustamante J.J. Drug-induced gynecomastia. Pharmacotherapy. 012. 32. 1123-1140. doi: 10.1002/phar.1138.
- Brinton L.A., Cook M.B., McCormack V., Johnson K.C., Olsson H., Casagrande J.T., Cooke R. et al. Anthropometric and hormonal risk factors for male breast cancer: male breast cancer pooling project results. Journal of the National Cancer Institute. 2014. 106. 465. doi: 10.1093/jnci/djt465.
- Nuttall F.Q. Gynecomastia as a physical finding in normal men. Journal of Clinical Endocrinology and Metabolism. 2014. 48. 338-340. doi: 10.1210/jcem-48-2-338.
- Laitman Y., Keinan Boker L., Liphsitz I., Weissglas-Volkov D., Litz-Philipsborn S., Schayek H., Friedman E. Cancer risks in Jewish male BRCA1 and BRCA2 mutation carriers. Breast Cancer Res. Treat. 2015. 150. 631-635. DOI: 10.1007/s10549-015-3340-4.
- Lotti F., Maggi M. Ultrasound of the male genital tract in relation to male reproductive health. Hum. Reprod. Update. 2015. 21(1). 56-83. doi: 10.1093/humupd/dmu042.
- Mieritz M.G., Christiansen P., Jensen M.B., Joensen U.N., Nordkap L., Olesen I.A., Bang A.K. et al. Gynaecomastia in 786 adult men: clinical and biochemical findings. Eur. J. Endocrinol. 2017. 176(5). 555-566. doi: 10.1530/EJE-16-0643.
- Narula H.S., Carlson H.E. Gynaecomastia — pathophysiology, diagnosis and treatment. Nat. Rev. Endocrinol. 2014. 10(11). 684-98. doi: 10.1038/nrendo.2014.139.
- Nieschlag E., Vorona E. Mechanisms in endocrinology: Medical consequences of doping with anabolic androgenic steroids: effects on reproductive functions. Eur. J. Endocrinol. 2015. 173(2). R47-58. doi: 10.1530/EJE-15-0080.
- Ordaz D.L., Thompson J.K. Gynecomastia and psychological functioning: a review of the literature. Body Image. 2015. 15. 141-148. doi.org/10.1016/j.bodyim.2015.08.004.
- Paris F., Gaspari L., Mbou F., Philibert P., Audran F., Morel Y., Biason-Lauber A., Sultan C. Endocrine and molecular investigations in a cohort of 25 adolescent males with prominent/persistent pubertal gynecomastia. Andrology. 2016. 4(2). 263-9. doi: 10.1111/andr.12145.
- Rew L., Young C., Harrison T., Caridi R. A systematic review of literature on psychosocial aspects of gynecomastia in adolescents and young men. J. Adolesc. 2015. 43. 206-12. doi: 10.1016/j.adolescence.2015.06.007.
- Sarkar A., Bain J., Bhattacharya D., Sawarappa R., Munian K., Dutta G., Naiyer G.J., Ahmad S. Role of Combined Circumareolar Skin Excision and Liposuction in Management of High grade Gynaecomastia. J. Cutan. Aesthet. Surg. 2014. 7(2). 112-6. doi: 10.4103/0974-2077.138354.