Международный эндокринологический журнал Том 17, №1, 2021
Вернуться к номеру
Клинико-диагностические аспекты дефицита тестостерона у женщин фертильного возраста
Авторы: Халимова З.Ю., Алмахматова А.А.
Ташкентский педиатрический медицинский институт, г. Ташкент, Республика Узбекистан
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
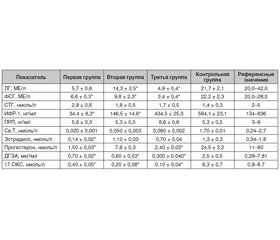
Актуальність. До сьогодні роль андрогенів в організмі жінки не отримала належної оцінки. Поки не існує чіткого і загальноприйнятого визначення поняття «андрогенний дефіцит у жінок» за аналогією з таким у чоловіків. Мета дослідження: вивчити клініко-діагностичні аспекти дефіциту тестостерону в жінок репродуктивного віку. Матеріали та методи. Під наглядом перебувало 60 жінок із дефіцитом тестостерону без супутньої патології. Середній вік пацієнток становив 28,3 року. Контрольну групу становили 20 здорових жінок. Пацієнтки були розподілені за показником індексу маси тіла (ІМТ) на три групи. Першу групу становили 20 жінок із надмірною масою тіла (ІМТ 25–29,9 кг/м2), другу групу — 20 жінок з ожирінням I ступеня і третю групу — 20 жінок з ожирінням II ступеня. Результати. Для пацієнток із групи з ожирінням I ступеня була характерна на 14-й день оваріально-менструального циклу тенденція до зниження базальних рівнів лютеїнізуючого гормона (ЛГ), фолікулостимулюючого гормона (ФСГ), естрадіолу і прогестерону на тлі вірогідної гіпоандрогенемії. У пацієнток із групи з ожирінням II ступеня відзначалося вірогідне зниження базальних рівнів ЛГ, ФСГ, естрадіолу, прогестерону на тлі вірогідної гіпоандрогенемії. При проведенні кореляційного аналізу виявлений прямий зв’язок дефіциту тестостерону зі ступенем ожиріння. Так, найнижчі значення тестостерону виявлені в пацієнток третьої групи (< 0,05 нмоль/л). Водночас у пацієнток першої і другої груп рівень тестостерону також був значно знижений — від 0,02 до 0,05 нмоль/л відповідно. Вірогідно зниженими виявилися рівні дегідроепіандростерону и 17-оксипрогестерону, особливо в третій групі — 0,3 мкг/мл і 0,1 нмоль/л відповідно. Висновки. У більшості жінок репродуктивного віку з дефіцитом тестостерону спостерігається гіпоменорея з низьким вмістом вільного тестостерону. Встановлено пряму кореляційну залежність дефіциту тестостерону від ступеня ожиріння в жінок з андрогенною недостатністю.
Актуальность. До настоящего времени роль андрогенов в организме женщины не вполне оценена. Пока не существует четкого и общепринятого определения понятия «андрогенный дефицит у женщин» по аналогии с таковым у мужчин. Цель исследования: изучить клинико-диагностические аспекты дефицита тестостерона у женщин фертильного возраста. Материалы и методы. Под наблюдением находилось 60 женщин с дефицитом тестостерона без сопутствующей патологии. Средний возраст пациенток составил 28,3 года. Контрольную группу составили 20 здоровых женщин. Пациентки были разделены по показателю индекса массы тела (ИМТ) на три группы. Первую группу составили 20 женщин с избыточной массой тела (ИМТ 25–29,9 кг/м2), вторую группу — 20 женщин с ожирением I степени и третью группу — 20 женщин с ожирением II степени. Результаты. Для пациенток из группы с ожирением I степени была характерна на 14-й день овариально-менструального цикла тенденция к снижению базальных уровней лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), эстрадиола и прогестерона на фоне достоверной гипоандрогенемии. У пациенток из группы с ожирением II степени отмечалось достоверное снижение базальных уровней ЛГ, ФСГ, эстрадиола, прогестерона на фоне достоверной гипоандрогенемии. При проведении корреляционного анализа обнаружена прямая связь дефицита тестостерона со степенью ожирения. Так, наиболее низкие значения тестостерона обнаружены у пациенток третьей группы (< 0,05 нмоль/л). В то же время у пациенток первой и второй групп уровень тестостерона также был значительно снижен — от 0,02 до 0,05 нмоль/л соответственно. Достоверно сниженными оказались уровни дегидроэпиандростерона и 17-оксипрогестерона, особенно в третьей группе — 0,3 мкг/мл и 0,1 нмоль/л соответственно. Выводы. У большинства женщин репродуктивного возраста с дефицитом тестостерона наблюдается гипоменорея с низким содержанием свободного тестостерона. Установлена прямая корреляционная зависимость дефицита тестостерона от степени ожирения у женщин с андрогенной недостаточностью.
Background. The role of androgens in a woman has not been fully appreciated. Currently, there is no clear and generally accepted definition of the concept of androgen deficiency in women by analogy with that in men. The purpose of the study was to investigate the clinical and diagnostic aspects of testosterone deficiency in women of fertile age. Materials and methods. The study included 60 women with testosterone deficiency without other concomitant pathology. The average age of the patients was 28.3 years. The control group consisted of 20 healthy women. The patients were divided into three groups based on their body mass index (BMI). The first group consisted of 20 overweight women (BMI 25–29.9 kg/m2), the second group — 20 women with first-degree obesity, and the third group — 20 women with second-degree obesity. Results. On the 14th day of the ovarian-menstrual cycle, the patients from the first group showed a tendency towards a decrease in the basal levels of luteinizing hormone (LH), follicle-stimulating hormone (FSH), estradiol, and progesterone against the background of significant hypoandrogenaemia. Patients with obesity (II degree) showed a significant decrease in basal levels of LH, FSH, estradiol, progesterone against the background of significant hypoandrogenaemia. The correlation analysis revealed a direct relationship between testosterone deficiency and obesity. Thus, the lowest testosterone values were found in patients of the third group (< 0.05 nmol/l). At the same time, the testosterone level in the patients of the first and second groups was also significantly reduced — from 0.02 to 0.05 nmol/l, respectively. The levels of dehydroepiandrosterone and 17-hydroxycorticosteroids were significantly reduced, especially in the third group — 0.3 μg/ml and 0.1 nmol/l, respectively. Conclusions. Most women of reproductive age with testosterone deficiency have hypomenorrhea with low free testosterone. A direct correlation was established between testosterone deficiency and the degree of obesity in women with androgen deficiency.
дефіцит тестостерону; жінки; репродуктивний вік
дефицит тестостерона; женщины; репродуктивный возраст
testosterone deficiency; women; reproductive age
Введение
Материалы и методы
Результаты
Обсуждение
Выводы
- Bienenfeld A., Azarchi S., Lo Sicco K., Marchbein S., Shapiro J., Nagler A.R. Androgens in women: Androgen-mediated skin disease and patient evaluation. J. Am. Acad. Dermatol. 2019. 80 (6). 1497-1506. doi: 10.1016/j.jaad.2018.08.062.
- Azarchi S., Bienenfeld A., Lo Sicco K., Marchbein S., Shapiro J., Nagler A.R. Androgens in women: Hormone-modulating therapies for skin disease. J. Am. Acad. Dermatol. 2019. 80 (6). 1509-1521. doi: 10.1016/j.jaad.2018.08.061.
- Carbajal-García A., Reyes-García J., Montaño L.M. Androgen Effects on the Adrenergic System of the Vascular, Airway, and Cardiac Myocytes and Their Relevance in Pathological Processes. Int. J. Endocrinol. 2020. 2020. 8849641. doi: 10.1155/2020/8849641.
- Burger H.G., Papalia M.A. A clinical update on female androgen insufficiency-testosterone testing and treatment in women presenting with low sexual desire. Sex. Health. 2006. 3 (2). 73-8. doi: 10.1071/sh05055.
- Davison S.L., Bell R., Donath S., Montalto J.G., Davis S.R. Androgen levels in adult females: changes with age, menopause, and oophorectomy. J. Clin. Endocrinol. Metab. 2005. 90 (7). 3847-53. doi: 10.1210/jc.2005-0212.
- Sturdee D.W., Pines A., International Menopause So–ciety Writing Group; Archer D.F., Baber R.J., Barlow D., Birkhäuser M.H., Brincat M., Cardozo L., de Villiers T.J. et al. Updated IMS recommendations on postmenopausal hormone therapy and preventive strategies for midlife health. Climacteric. 2011. 14 (3). 302-20. doi: 10.3109/13697137.2011.570590.
- Wierman M.E., Basson R., Davis S.R., Khosla S., Miller K.K., Rosner W., Santoro N. Androgen Therapy in Women: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism. 2006. 91 (10). 3697-3710. https://doi.org/10.1210/jc.2006-1121.
- Vegunta S., Kling J.M., Kapoor E. Androgen Therapy in Women. J. Womens Health (Larchmt). 2020. 29 (1). 57-64. doi: 10.1089/jwh.2018.7494.
- Arlt W. Androgen therapy in women. Eur. J. Endocrinol. 2006. 154 (1). 1-11. doi: 10.1530/eje.1.02062.
- Braunstein G.D. Androgen insufficiency in women: summary of critical issues. Fertil Steril. 2002. 77. Suppl. 4. S94-9. doi: 10.1016/s0015-0282 (02)02962-x.
- Mathur R., Braunstein G.D. Androgen deficiency and therapy in women. Curr Opin Endocrinol Diabetes Obes. 2010. 17 (4). 342-9. doi: 10.1097/MED.0b013e32833ab083.
- Mohamed O., Freundlich R.E., Dakik H.K., Grober E.D., Najari B., Lipshultz L.I., Khera M. The quantitative ADAM questionnaire: a new tool in quantifying the severity of hypogonadism. Int. J. Impot. Res. 2010. 22 (1). 20-4. doi: 10.1038/ijir.2009.35.
- Chueh K.S., Huang S.P., Lee Y.C., Wang C.J., Yeh H.C., Li W.M., Wu W.J. et al. The comparison of the aging male symptoms (AMS) scale and androgen deficiency in the aging male (ADAM) questionnaire to detect androgen deficiency in middle-aged men. J. Androl. 2012. 33 (5). 817-23. doi: 10.2164/jandrol.111.015628.
- Glaser R., Dimitrakakis C. Testosterone therapy in women: Myths and misconceptions. Maturitas. 2013. pii: S0378-5122. 13. 00012-1. doi: 10.1016/j.maturitas.2013.01.003.
- Rivera-Woll L.M., Papalia M., Davis S.R., Burger H.G. Androgen insufficiency in women: diagnostic and therapeutic implications. Hum. Reprod. Update. 2004. 10 (5). 421-32. doi: 10.1093/humupd/dmh037.
- Tyagi V., Scordo M., Yoon R.S., Liporace F.A., Greene L.W. Revisiting the role of testosterone: Are we missing something? Rev. Urol. 2017. 19 (1). 16-24. doi: 10.3909/riu0716.
- Pavičić Baldani D., Škrgatić L., Bukvić Mokos Z., Trgovčić I. Hyperandrogenemia association with acne and hirsutism severity in Croatian women with polycystic ovary syndrome. Acta Dermatovenerol. Croat. 2013. 21. 105-112. PMID: 24001418.
- Morales A., Collier C.P., Clark A.F. A critical appraisal of accuracy and cost of laboratory methodologies for the diagnosis of hypogonadism: the role of free testosterone assays. Can. J. Urol. 2012. 19. 6314-6318. PMID: 22704323.
- Bhasin S., Cunningham G.R., Hayes F.J. et al. Task Force, Endocrine Society. Testosterone therapy in men with androgen deficiency syndromes: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2010. 95. 2536-2559. https://doi.org/10.1210/jc.2005-2847
- Bassil N., Alkaade S., Morley J.E. The benefits and risks of testosterone replacement therapy: a review. Ther. Clin. Risk Manag. 2009. 5. 427-448. doi: 10.2147/tcrm.s3025

/101.jpg)
/102.jpg)