Международный эндокринологический журнал Том 17, №2, 2021
Вернуться к номеру
Діагностична та прогностична цінність гормональних показників, ліпідного спектра та ультрасонографічних параметрів міокарда при метаболічному синдромі, ускладненому хронічною ішемічною хворобою серця і цукровим діабетом 2-го типу
Авторы: Дутка Р.Я.(1), Чмир Н.В.(1), Леонт’єва З.Р.(1), Федечко Й.М.(2)
(1) — Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) — ВКНЗ ЛОР «Львівська медична академія імені Андрея Крупинського, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
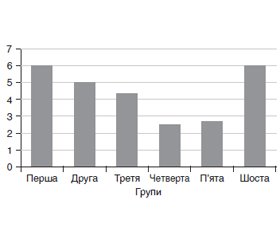
Актуальність. Синтропічна патологія, зумовлена поєднанням метаболічних і гормональних змін, призводить до розвитку ускладнень серцево-судинної патології як безпосередньої причини смертності та зменшення тривалості чи якості життя населення. Щодо ролі гормонів при даній комплексній патології слід зауважити, що не повністю доведена їх патогенетична і клінічна взаємозалежність та кореляція із морфофункціональними параметрами стану міокарда. Методологічні труднощі таких досліджень полягають у потребі аналізувати десятки лабораторно-клінічних показників у багатьох групах порівняння. Мета дослідження: встановити діагностичні маркери при метаболічному синдромі, а також їх взаємозалежність порівняно із синтропічною патологією, представленою хронічною ішемічною хворобою серця (ІХС) та цукровим діабетом (ЦД) 2-го типу. Матеріали та методи. У дослідження залучені 319 пацієнтів, розподілених на 6 груп. Першу групу становили 82 пацієнти з метаболічним синдромом (МС), другу — із МС та ЦД компенсованим (39 осіб), третю — із МС та ЦД декомпенсованим (35 осіб), четверту — 44 особи з МС та появою ІХС, п’яту — 44 хворі на ІХС та ЦД 2-го типу в стані компенсації, що виник на тлі МС, шосту — 75 пацієнтів з ІХС та ЦД 2-го типу в стані декомпенсації на тлі МС. У контрольну групу увійшли 40 практично здорових осіб (чоловіки — 17, жінки — 23). Результати. У жінок віком до 40 років із МС без ЦД 2-го типу при підвищеному рівні пролактину, кортизолу та тиреотропного гормона (ТТГ) діагноз ІХС об’єктивно не підтверджується. При цьому спостерігалися вже початкові зміни ліпідного обміну за рахунок підвищення рівня тригліцеридів та ліпопротеїнів дуже низької щільності. Поява ІХС на фоні МС (лише за умови відсутності ЦД 2-го типу) характеризується наближеними до контролю рівнями пролактину та кортизолу на фоні значного підвищення ТТГ у всіх пацієнтів незалежно від статі. У четвертій групі пацієнтів з ІХС на тлі МС високому значенню суми індексів (∑і) ліпідного спектра відповідає найнижчий показник суми індексів гормонів. Для шостої групи з ІХС у поєднанні з декомпенсованим ЦД 2-го типу характерні найвищі показники ∑і як ліпідного обміну, так і гормонів. При поєднанні МС з ІХС та компенсованим ЦД 2-го типу рівні гормонів та ліпідів не відрізнялися від таких при МС з ІХС без ЦД 2-го типу. При МС, ускладненому декомпенсованим ЦД 2-го типу та ІХС, спостерігались підвищені рівні кортизолу і пролактину, при цьому рівень ТТГ був у нормі. Висновки. Установлено діагностичні маркери (гормональні показники, параметри ліпідного спектра й ультрасонографічні параметри міокарда) при МС, а також виявлено їх взаємозалежність порівняно із синтропічною патологією, представленою ІХС та ЦД 2-го типу.
Background. Concomitant diseases due to a combination of metabolic and hormonal changes lead to the development of cardiovascular complications as a direct cause of death and reduced duration or quality of population’s life. The role of hormones in this combined pathology, especially their nosotropic and clinical relationship and correlation with the morphofunctional parameters of the myocardium, has not been studied thoroughly. It is difficult to analyse a lot of laboratory indexes in many comparison groups. The purpose is to set diagnostic markers in metabolic syndrome (MS) and also their relationship compared to combined pathology such as chronic coronary artery disease (CAD) and type 2 diabetes mellitus (DM). Materials and methods. Three hundred and nineteen patients were examined and divided into 6 groups: 82 people with metabolic syndrome were in the first group; 39 with compensated type 2 DM which developed as a result of МS — in the second group; 35 with DM and decompensated type 2 DM — in the third group; 44 individuals with МS complicated by CAD — in the fourth group; 44 with CAD and compensated type 2 DM which developed against the background of МS — in the fifth group; 75 with CAD and decompensated type 2 DM — in the sixth group. The control group consisted of 40 healthy individuals (17 men and 23 females). Then, the levels of prolactin, cortisol, free thyroxinе, thyroid-stimulating hormone, blood lipids were measured and cardiac ultrasonography was performed. An integral index for evaluating the significance of study results was used. It was calculated by the ratio of comparison group median to the control group median. The level ≥ 1.2 was set as a significance result. The sum of indexes (∑і) was calculated to describe changes in group indexes. Results. It is found that diagnosis of CAD objectively was not confirmed in female patients younger than 40 years with МS without type 2 DM with increased prolactin, cortisol, and thyroid-stimulating hormone. Thus, there already were initial changes of lipid exchange due to an increase in triglycerides and very low-density lipoprotein cholesterol levels. Occurrence of CAD on the MS background (only in the absence of type 2 DM) is characterized by almost normal levels of prolactin and cortisol with significantly increased content of thyroid-stimulating hormone in all patients, regardless of gender. Metabolic disorders of blood lipids (increased triglycerides, low-density lipoprotein cholesterol, very low-density lipoprotein cholesterol, total cholesterol, decreased high-density lipoprotein cholesterol), changes in the structural and functional state of the myocardium (increased left atrial anteroposterior diameter, left ventricular end-diastolic dimension, interventricular septal thickness and left ventricular posterior wall thickness) were observed in patients with CAD on the background of MS. Analysis of the correlation of ∑і of blood lipids, hormones with ultrasonography parameters found that in the 4th group of patients with CAD, the high value of blood lipid ∑і corresponds to the lowest ∑і of hormone indices. The 6th group of individuals with CAD combined with the decompensated type 2 DM is characterized by highest ∑і of both lipid exchange and hormones. The changes in the structural and functional state of myocardium are nonspecific, more expressed with the combined pathology. In MS combined with CAD and compensated type 2 DM, the levels of hormones and lipids did not differ from those in MS with CAD without type 2 DM. There were increased levels of cortisol and prolactin with normal level of ТSH in MS complicated by decompensated type 2 DM and CAD. Analysis of blood lipids demonstrated increased levels of thyroid-stimulating hormone, triglycerides, low-density lipoprotein cholesterol, very low-density lipoprotein cholesterol and decreased content of high-density lipoprotein cholesterol with significant ultrasonography changes as an increase in the left atrial anteroposterior diameter, left ventricular end-diastolic dimension, interventricular septal thickness, left ventricular posterior wall thickness and decreased ejection fraction. Conclusions. Diagnostic markers (hormone levels, blood lipid parameters and ultrasonographic changes in the myocardium) were determined in metabolic syndrome, and also their relationship was studied compared to combined pathology of CAD and type 2 DM.
цукровий діабет 2-го типу; метаболічний синдром; пролактин; тиреотропний гормон; кортизол; ішемічна хвороба серця
type 2 diabetes mellitus; metabolic syndrome; prolactin; thyroid-stimulating hormone; cortisol; coronary artery disease
Вступ
Матеріали та методи
Результати та обговорення
/40.jpg)
Обговорення
Висновки
- Van Herpt T.T., Dehghan A., van Hoek M., Ikram M.A., Hofman A., Sijbrands E.J., Franco O.H. The clinical value of metabolic syndrome and risks of cardiometabolic events and mortality in the elderly: the Rotterdam study. Cardiovascular Diabetology. 2016. 15(1). 69. doi: 10.1186/s12933-016-0387-4.
- Montazerifar F., Bolouri A., Mozaffar M.M., Karajibani M. The prevalence of metabolic syndrome in coronary artery disease patients. Cardiology Research. 2016. 7(6). 202-208. DOI: 10.14740/cr507w.
- Van Vliet-Ostaptchouk J.V., Nuotio M.L., Slagter S.N., Doiron D., Fischer K., Foco L., Joensuu A. The prevalence of metabolic syndrome and metabolically healthy obesity in Europe: a collaborative analysis of ten large cohort studies. BMC Endocrine Disorders. 2014. 14. 9. DOI: 10.1186/1472-6823-14-9.
- Kleinherenbrink W., Osei E., den Hertog H.M., Zandbergen A.A.M. Prediabetes and macrovascular disease: Review of the association, influence on outcome and effect of treatment. European Journal of Internal Medicine. 2018. 55. 6-11. doi: 10.1016/j.ejim.2018.07.001.
- Kautzky-Willer A., Harreiter J., Pacini G. Sex and Gender Differences in Risk, Pathophysiology and Complications of Type 2 Diabetes Mellitus. Endocr. Rev. 2016. 37(3). 278-316. doi: 10.1210/er.2015-1137.
- Popovic D., Damjanovic S., Djordjevic T., Martic D., Ignjatovic S., Milinkovic N., Arena R. Stress hormones at rest and following exercise testing predict coronary artery disease severity and outcome. Stress. 2017. 20(5). 523-531. https://doi.org/10.1080/10253890.2017.1368488.
- Joseph J.J., Golden S.H. Cortisol dysregulation: the bidirectional link between stress, depression, and type 2 diabetes mellitus. Ann. N. Y. Acad. Sci. 2017. 1391(1). 20-34. doi: 10.1111/nyas.13217.
- Velarde G.P., Sherazi C., Cremer D.F. Clinical and Biochemical Markers of Cardiovascular Structure and Function in Women With the Metabolic Syndrome American Journal of Cardiology. 2015. 116(11). 1705-1710. DOI: 10.1016/j.amjcard.2015.09.010.
- International Diabetes Federation Epidemiology Task Force Consensus Group. The IDF consensus worldwide definition of the metabolic syndrome. International Diabetes Federation. Brussels: 2005. (Available at: ww.idf.org/webdata/docs/IDF_ Metasyndrome_definition.pdf).
- Bhatheja S., Panchal H.B., Ventura H., Paul T.K. Obesity cardiomyopathy: pathophysiologic factors and nosologic reevaluation. The American Journal of the Medical Sciences. 2016. 352. 219-222. doi: 10.1016/j.amjms.2016.05.014.
- Incollingo Rodriguez A.C., Epel E.S., White M.L., Standen E.C., Seckl J.R., Tomiyama A.J. Hypothalamic-pituitary-adrenal axis dysregulation and cortisol activity in obesity: A systematic review. Psychoneuroendocrinology. 2015. 62. 301-318. doi: 10.1016/j.psyneuen.2015.08.014.
- Raaz D., Wallaschofski H., Stumpf C., Yilmaz A., Cicha I., Klinghammer L., Daniel W.G., Lohmann T., Garlichs C.D. Increased prolactin in acute coronary syndromes as putative Co-activator of ADP-stimulated P-selectin expression. Horm. Metab. Res. 2006. 38(11). 767-772. doi: 10.1055/s-2006-955090.
- Al-Kuraishy H.M., Al-Gareeb A.I., Awad M.S., Alrifai S.B. Assessment of serum prolactin levels in acute myocardial infarction: The role of pharmacotherapy. Indian J. Endocrinol. Metab. 2016. 20(1). 72-79. doi: 10.4103/2230-8210.172240.
- Balbach L., Wallaschofski H., Völzke H., Nauck M., Dörr M., Haring R. Serum prolactin concentrations as risk factor of metabolic syndrome or type 2 diabetes? BMC Endocrine Disorders. 2013. 13. 12. DOI: 10.1186/1472-6823-13-12.
- Therkelsen K.E., Abraham T.M., Pedley A., Massaro J.M., Sutherland P., Hoffmann U., Fox C.S. Association Between Prolactin and Incidence of Cardiovascular Risk Factors in the Framingham Heart Study. J. Am. Heart Assoc. 2016. 5(2). e002640. doi: 10.1161/JAHA.115.002640.
- Yang L., Lv X., Yue F., Wei D., Liu W., Zhang T. Subclinical hypothyroidism and the risk of metabolic syndrome: a meta-analysis of observational studies. Endocrine Research. 2016. 41. 158-165. DOI: 10,3109 / 07435800.2015.1108332.

/39.jpg)
/41.jpg)
/42.jpg)
/43.jpg)