Международный эндокринологический журнал Том 17, №4, 2021
Вернуться к номеру
Роль тонкоголкової аспіраційної біопсії та гістологічного дослідження в оцінці вузлів щитоподібної залози
Авторы: Xhardo E., Xhemalaj D., Agaçi F. , Kapisyzi P.
University Hospital “Shefqet Ndroqi”, Tirana, Albania
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
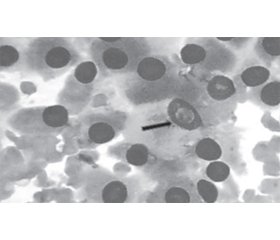
Вузли щитоподібної залози становлять вагому проблему і в основному не мають онкологічної характеристики. Таким чином, вони здебільшого не потребують хірургічного лікування. Ризик малігнізації перебуває в межах від 5 до 15 %. Етапи діагностики злоякісної пухлини повинні включати ретельну клінічну оцінку, лабораторні дослідження, ультразвукове дослідження щитоподібної залози та тонкоголкову аспіраційну пункційну біопсію (ТАПБ). ТАПБ є найважливішим діагностичним інструментом при оцінці вузлів щитоподібної залози. Сьогодні вона розглядається як золотий стандарт діагностики злоякісних новоутворень при раку щитоподібної залози. В огляді автори оцінюють роль ТАПБ та можливості цитологічного дослідження в оцінці вузлів щитоподібної залози. Результати ТАПБ класифікуються як діагностичні (задовільні) або недіагностичні (незадовільні). Незадовільні результати (5–10 %) є наслідком міжклітинних зразків, зазвичай спричинених кістозною рідиною, кров’янистими мазками або неоптимальною підготовкою. Діагностичні мазки зазвичай класифікують на доброякісні, невизначені або злоякісні. Доброякісна цитологія (60–70 %) є негативною для злоякісної пухлини і включає кісти, колоїдний вузол або тиреоїдит Хашимото. Злоякісна цитологія (5 %) майже завжди є позитивною для злоякісної пухлини і містить первинні пухлини щитоподібної залози або нетиреоїдні метастатичні раки. Невизначені або підозрілі зразки (10–20 %) включають атипові зміни, клітини Хартла або фолікулярні новоутворення. Нова цитологічна класифікація Bethesda включає класифікацію шести категорій факторів ризику. З огляду на зростаючу у всьому світі кількість захворювань на мікроаденоми щитоподібної залози останнім часом рекомендується здійснювати ТАПБ за допомогою УЗД навіть при невеликих (< 1 см) вузлах, якщо вони співвідносяться з підозрілими ультразвуковими ознаками або підозрілими лімфатичними вузлами шиї. ТАПБ — це доступний та надійний діагностичний інструмент, що може бути використаний при відборі пацієнтів на операцію та передопераційну діагностику карцином щитоподібної залози. Автори дійшли висновку, що ТАПБ є золотим стандартом при оцінці вузлів щитоподібної залози і може запобігти багатьом непотрібним операціям. Хибнонегативна цитологія залишається проблемою для клініцистів, які лікують пацієнтів із вузлами щитоподібної залози. Післяопераційна гістологія дає остаточний діагноз. Дослідження підтверджують, що вона має суттєві розбіжності між передопераційною цитологією та післяопераційною гістологією в пацієнтів із вузлами щитоподібної залози. Цитопатологи повинні уточнити свої критерії для виявлення аденоматозної гіперплазії, тиреоїдиту, кістозних уражень або підозрілих вузлів щитоподібної залози, щоб уникнути помилкового діагнозу.
Thyroid nodules present a serious problem, and mostly they do not carry neoplastic characteristics. Thus, they do not need to be surgically treated. The risk of malignancy varies from 5 to 15 %. Steps to diagnose malignancy should include a careful clinical evaluation, laboratory tests, a thyroid ultrasound exam and a fine-needle aspiration biopsy. Fine-needle aspiration biopsy (FNAB) is the most important diagnostic tool in the assessment of thyroid nodules. Today it is considered the gold standard for malignancy diagnosis in thyroid cancer. In this review we evaluate the role of FNAB and post-operative cytology in the evaluation of thyroid nodules. FNA results are classified as diagnostic (satisfactory) or nondiagnostic (unsatisfactory). Unsatisfactory smears (5–10 %) result from hypocellular specimens usually caused by cystic fluid, bloody smears, or suboptimal preparation. Diagnostic smears are conventionally subclassified into benign, indeterminate, or malignant categories. Benign cytology (60–70 %) is negative for malignancy, and includes cysts, colloid nodule, or Hashimoto thyroiditis. Malignant cytology (5 %) is almost always positive for malignancy, and includes primary thyroid tumors or nonthyroid metastatic cancers. Indeterminate or suspicious specimens (10–20 %) include atypical changes, Hurthle cells or follicular neoplasms. The new Bethesda Cytologic Classification has a 6-category classification, subdividing indeterminate further by risk factors. Considering the increasing worldwide incidence of thyroid microadenomas, recently it is recommended to undergo FNAB under ultrasound guidance even in small (< 1cm) nodules if they are correlated with suspicious ultrasonographic features or suspicious neck lymph nodes. FNAB is a cheap and reliable diagnostic tool that can be used in the selection candidates for surgery and pre-operative diagnosis of thyroid carcinomas. It was concluded that FNAB is the gold standard in the evaluation of thyroid nodules and can prevent many unnecessary surgeries. False-negative FNA cytology remains a concern for clinicians treating patients with thyroid nodules. Post-operative histology give the definitive diagnosis and studies confirm that it has a significant discordance between pre-operative cytology and post-operative histology in patients with thyroid nodule. Cytopathologists should strengthen their criteria for the identification of adenomatous hyperplasia, thyroiditis, cystic lesions or suspicious thyroid nodules to avoid misdiagnoses.
вузли щитоподібної залози; тонкоголкова аспіраційна пункційна біопсія; цитологічне дослідження; огляд
thyroid nodules; fine-needle aspiration biopsy; post-operative cytology; Bethesda classification; review
Introduction
Fine-needle aspiration (FNA) biopsy of thyroid nodules
False-negative and false-positive rate of thyroid nodule FNA
Causes of false diagnoses
Diagnostic accuracy
FNA guidelines
The Bethesda criteria
Thyroid microcarcinomas
Post-operative histology
Discussions
Conclusions
- Kavanagh J., McVeigh N., McCarthy E., Bennett K., Beddy P. Ultrasound-guided fine needle aspiration of thyroid nodules: factors affecting diagnostic outcomes and confounding variables. Acta Radiol. 2017. 58(3). 301-306. doi: 10.1177/0284185116654331.
- Varshney R., Forest V.I., Zawawi F., Rochon L., Hier M.P., Mlynarek A., Tamilia M., Payne R.J. Ultrasound-guided fine-needle aspiration of thyroid nodules: does size matter? Am. J. Otolaryngol. 2014. 35(3). 373-376. doi: 10.1016/j.amjoto.2013.12.005.
- Wong R., Farrell S.G., Grossmann M. Thyroid nodules: diagnosis and management. Med. J. Aust. 2018. 209(2). 92-98. doi: 10.5694/mja17.01204.
- Durante C., Grani G., Lamartina L., Filetti S., Mandel S.J., Cooper D.S. The Diagnosis and Management of Thyroid Nodules: A Review. JAMA. 2018. 319(9). 914-924. doi: 10.1001/jama.2018.0898.
- Singh Ospina N., Iñiguez-Ariza N.M., Castro M.R. Thyroid nodules: diagnostic evaluation based on thyroid cancer risk assessment. BMJ. 2020. 368. 16670. doi: 10.1136/bmj.l6670.
- Cordes M., Schmidkonz C., Horstrup K., Weppler M., Kuwert T. Fine-needle aspiration biopsies of thyroid nodules. Nuklearmedizin. 2018. 57(6). 211-215. doi: 10.3413/Nukmed-0981-18-06.
- Jack G.A., Sternberg S.B., Aronson M.D., Mukamal K.J., Oshin A., Hennessey J.V. Nondiagnostic Fine-Needle Aspiration Biopsy of Thyroid Nodules: Outcomes and Determinants. Thyroid. 2020. 30(7). 992-998. doi: 10.1089/thy.2019.0140.
- Haugen B.R., Alexander E.K., Bible K.C., Doherty G.M., Mandel S.J., Nikiforov Y.E., Pacini F. et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016. 26(1). 1-133. doi: 10.1089/thy.2015.0020.
- Choe J., Baek J.H., Park H.S., Choi Y.J., Lee J.H. Core needle biopsy of thyroid nodules: outcomes and safety from a large single-center single-operator study. Acta Radiol. 2018. 59(8). 924-931. doi: 10.1177/0284185117741916.
- Mais D.D., Crothers B.A., Davey D.D., Natale K.E., Nayar R., Souers R.J., Blond B.J. et al. Trends in Thyroid Fine-Needle Aspiration Cytology Practices: Results From a College of American Pathologists 2016 Practice Survey. Arch. Pathol. Lab. Med. 2019. 143(11). 1364-1372. doi: 10.5858/arpa.2018-0429-CP.
- Alvarado-Santiago M., Alvarez-Valentin D., Ruiz-Bermudez O., Gonzalez-Sepulveda L., Allende-Vigo M., Santiago-Rodriguez E., Rivas-Tumanyan S. Fine-Needle Thyroid Aspiration Biopsy: Clinical Experience at the Endocrinology Clinics of the University Hospital of Puerto Rico. P. R. Health Sci. J. 2017. 36(1). 5-10. PMID: 28266693; PMCID: PMC5624044.
- Crothers B.A., Darragh T.M., Tambouret R.H., Nayar R., Barkan G.A., Zhao C., Booth C.N. et al. Trends in Cervical Cytology Screening and Reporting Practices: Results From the College of American Pathologists 2011 PAP Education Supplemental Questionnaire. Arch. Pathol. Lab. Med. 2016. 140(1). 13-21. doi: 10.5858/arpa.2015-0004-CP.
- Padmanabhan V., Barkan G.A., Tabatabai L., Souers R., Nayar R., Crothers B.A. Touch imprint (TI) cytology of needle core biopsies (NCB) in pathology laboratories: A practice survey of participants in the College of American Pathologists (CAP) Non Gynecologic Cytopathology (NGC) Education Program. Diagn. Cytopathol. 2019. 47(3). 149-155. doi: 10.1002/dc.24023.
- Gürkan Dumlu E., Kiyak G., Bozkurt B., Tokaç M., Polat B., Cakir B., Güler G., Kiliç M. Correlation of thyroid fine-needle aspiration with final histopathology: a case series. Minerva Chir. 2013. 68(2). 191-197. PMID: 23612233.
- Ha S.M., Kim J.K., Baek J.H. Detection of Malignancy Among Suspicious Thyroid Nodules < 1 cm on Ultrasound with Various Thyroid Image Reporting and Data Systems. Thyroid. 2017. 27(10). 1307-1315. doi: 10.1089/thy.2017.0034.
- Jackson B.S. Controversy regarding when clinically suspicious thyroid nodules should be subjected to surgery: Review of current guidelines. Medicine (Baltimore). 2018. 97(50). e13634. doi: 10.1097/MD.0000000000013634.
- Cesur M., Corapcioglu D., Bulut S., Gursoy A., Yilmaz A.E., Erdogan N., Kamel N. Comparison of palpation-guided fine-needle aspiration biopsy to ultrasound-guided fine-needle aspiration biopsy in the evaluation of thyroid nodules. Thyroid. 2006. 16(6). 555-561. doi: 10.1089/thy.2006.16.555.
- Robitschek J., Straub M., Wirtz E., Klem C., Sniezek J. Diagnostic efficacy of surgeon-performed ultrasound-guided fine needle aspiration: a randomized controlled trial. Otolaryngol. Head Neck Surg. 2010. 142(3). 306-309. doi: 10.1016/j.otohns.2009.11.011.
- Giuffrida D., Gharib H. Controversies in the management of cold, hot, and occult thyroid nodules. Am. J. Med. 1995. 99(6). 642-650. doi: 10.1016/s0002-9343(99)80252-6.
- Bakhos R., Selvaggi S.M., DeJong S., Gordon D.L., Pitale S.U., Herrmann M., Wojcik E.M. Fine-needle aspiration of the thyroid: rate and causes of cytohistopathologic discordance. Diagn. Cytopathol. 2000. 23(4). 233-237. doi: 10.1002/1097-0339(200010)23:4<233::aid-dc3>3.0.co;2-l.
- Bongiovanni M., Spitale A., Faquin W.C., Mazzucchelli L., Baloch Z.W. The Bethesda System for Reporting Thyroid Cytopathology: a meta-analysis. Acta Cytol. 2012. 56(4). 333-339. doi: 10.1159/000339959.
- Gul K., Ersoy R., Dirikoc A., Korukluoglu B., Ersoy P.E., Aydin R., Ugras S.N. et al. Ultrasonographic evaluation of thyroid nodules: comparison of ultrasonographic, cytological, and histopathological findings. Endocrine. 2009. 36(3). 464-472. doi: 10.1007/s12020-009-9262-3.
- Mekel M., Gilshtein H., Al-Kurd A., Bishara B., Krausz M.M., Freund H.R., Kluger Y. et al. Negative Fine-Needle Aspiration in Patients with Goiter: Should We Doubt It? World J. Surg. 2016. 40(1). 124-128. doi: 10.1007/s00268-015-3216-0.
- Wu H.H., Jones J.N., Osman J. Fine-needle aspiration cytology of the thyroid: ten years experience in a community teaching hospital. Diagn. Cytopathol. 2006 Feb. 34(2). 93-96. doi: 10.1002/dc.20389. PMID: 16514671.
- Lee Y.H., Lee N.J., Kim J.H., Suh S.I., Kim T.K., Song J.J. Sonographically guided fine needle aspiration of thyroid nodule: discrepancies between cytologic and histopathologic findings. J. Clin. Ultrasound. 2008 Jan. 36(1). 6-11. doi: 10.1002/jcu.20412. PMID: 17924577.
- Deng D., Chen X., Wang H., Wu H. Typical manifestations of Hürthle cell adenoma of the thyroid on contrast-enhanced CT: A case report. Medicine (Baltimore). 2019. 98(22). e15866. doi: 10.1097/MD.0000000000015866.
- Bohacek L., Milas M., Mitchell J., Siperstein A., Berber E. Diagnostic accuracy of surgeon-performed ultrasound-guided fine-needle aspiration of thyroid nodules. Ann. Surg. Oncol. 2012. 19(1). 45-51. doi: 10.1245/s10434-011-1807-z.
- Lew J.I., Snyder R.A., Sanchez Y.M., Solorzano C.C. Fine needle aspiration of the thyroid: correlation with final histopathology in a surgical series of 797 patients. J. Am. Coll. Surg. 2011. 213(1). 188-194; discussion 194-5. doi: 10.1016/j.jamcollsurg.2011.04.029.
- Richmond B.K., Judhan R., Chong B., Ubert A., AbuRahma Z., Mangano W., Thompson S. False-negative results with the Bethesda System of reporting thyroid cytopathology: predictors of malignancy in thyroid nodules classified as benign by cytopathologic evaluation. Am. Surg. 2014. 80(8). 811-816. PMID: 25105404; PMCID: PMC4476287.
- Gharib H., Papini E., Paschke R., Duick D.S., Valcavi R., Hegedüs L., Vitti P. AACE/AME/ETA Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules: executive summary of recommendations. J. Endocrinol. Invest. 2010. 33(Suppl. 5). 51-56. PMID: 20543551.
- Zhu Y., Song Y., Xu G., Fan Z., Ren W. Causes of misdiagnoses by thyroid fine-needle aspiration cytology (FNAC): our experience and a systematic review. Diagn. Pathol. 2020, Jan 3. 15(1). 1. doi: 10.1186/s13000-019-0924-z. PMID: 31900180; PMCID: PMC6942345.
- McCoy K.L., Jabbour N., Ogilvie J.B., Ohori N.P., Carty S.E., Yim J.M. The incidence of cancer and rate of false-ne–gative cytology in thyroid nodules greater than or equal to 4 cm in size. Surgery. 2007. 142(6). 837-844. https://doi.org/10.1016/j.surg.2007.08.012.
- Porterfield J.R. Jr, Grant C.S., Dean D.S., Thompson G.B., Farley D.R., Richards M.L., Reading C.C. et al. Reliability of benign fine needle aspiration cytology of large thyroid nodules. Surgery. 2008. 144(6). 963-968; discussion 968-9. doi: 10.1016/j.surg.2008.09.006.
- Agcaoglu O., Aksakal N., Ozcinar B., Sarici I.S., Ercan G., Kucukyilmaz M., Yanar F. et al. Factors that affect the false-negative outcomes of fine-needle aspiration biopsy in thyroid nodules. Int. J. Endocrinol. 2013. 2013. 126084. doi: 10.1155/2013/126084.
- Malheiros D.C., Canberk S., Poller D.N., Schmitt F. Thyroid FNAC: Causes of false-positive results. Cytopathology. 2018. 29(5). 407-417. doi: 10.1111/cyt.12575.
- Erkinuresin T., Demirci H. Diagnostic accuracy of fine needle aspiration cytology of thyroid nodules. Diagnosis (Berl.). 2020. 7(1). 61-66. doi: 10.1515/dx-2019-0039.
- Dean D.S., Gharib H. Fine-Needle Aspiration Biopsy of the Thyroid Gland. 2015, Apr 26. In: Feingold K.R., Anawalt B., Boyce A., Chrousos G., de Herder W.W., Dhatariya K., Dungan K. et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000. PMID: 25905400.
- Ogilvie J.B., Piatigorsky E.J., Clark O.H. Current status of fine needle aspiration for thyroid nodules. Adv. Surg. 2006. 40. 223-238. doi: 10.1016/j.yasu.2006.06.003. PMID: 17163105.
- Banks N.D., Kowalski J., Tsai H.L., Somervell H., Tufano R., Dackiw A.P., Marohn M.R. et al. A diagnostic predictor model for indeterminate or suspicious thyroid FNA samples. Thyroid. 2008. 18(9). 933-941. doi: 10.1089/thy.2008.0108. PMID: 18788917.
- Cibas E.S., Ali S.Z. The Bethesda System for Reporting Thyroid Cytopathology. Am. J. Clin. Pathol. 2009. 132. 658-665. doi: 10.1309/AJCPPHLWMI3JV4LA.
- Cibas E.S., Sanchez M.A. The National Cancer Institute thyroid fine-needle aspiration state-of-the-science conference: inspiration for a uniform terminology linked to management guidelines. Cancer. 2008. 114(2). 71-73. doi: 10.1002/cncr.23343. PMID: 18300233.
- Baloch Z.W., Cibas E.S., Clark D.P., Layfield L.J., Ljung B.M., Pitman M.B., Abati A. The National Cancer Institute Thyroid fine needle aspiration state of the science conference: a summation. Cytojournal. 2008. 5. 6. doi: 10.1186/1742-6413-5-6.
- Hambleton C., Kandil E. Appropriate and accurate diagnosis of thyroid nodules: a review of thyroid fine-needle aspiration. Int. J. Clin. Exp. Med. 2013. 6(6). 413-422. PMID: 23844264; PMCID: PMC3703111.
- Elisei R., Molinaro E., Agate L., Bottici V., Masserini L., Ceccarelli C., Lippi F. et al. Are the clinical and pathological features of differentiated thyroid carcinoma really changed over the last 35 years? Study on 4187 patients from a single Italian institution to answer this question. J. Clin. Endocrinol. Metab. 2010. 95(4). 1516-1527. doi: 10.1210/jc.2009-1536.
- Ito Y., Miyauchi A., Inoue H., Fukushima M., Kihara M., Higashiyama T., Tomoda C. et al. An observational trial for papillary thyroid microcarcinoma in Japanese patients. World J. Surg. 2010 Jan. 34(1). 28-35. doi: 10.1007/s00268-009-0303-0. PMID: 20020290.
- Mehanna R., Murphy M., McCarthy J., O’Leary G., Tuthill A., Murphy M.S., Sheahan P. False negatives in thyroid cytology: impact of large nodule size and follicular variant of papillary carcinoma. Laryngoscope. 2013. 123(5). 1305-1309. doi: 10.1002/lary.23861.
- Pinchot S.N., Al-Wagih H., Schaefer S., Sippel R., Chen H. Accuracy of fine-needle aspiration biopsy for predicting neoplasm or carcinoma in thyroid nodules 4 cm or larger. Arch. Surg. 2009. 144(7). 649-655. doi: 10.1001/archsurg.2009.116.
- Rosen J.E., Stone M.D. Contemporary diagnostic approach to the thyroid nodule. J. Surg. Oncol. 2006, Dec 15. 94(8). 649-661. doi: 10.1002/jso.20701. PMID: 17131409.
- Bilimoria K.Y., Bentrem D.J., Ko C.Y., Stewart A.K., Winchester D.P., Talamonti M.S., Sturgeon C. Extent of surgery affects survival for papillary thyroid cancer. Ann. Surg. 2007. 246(3). 375-381. doi: 10.1097/SLA.0b013e31814697d9.
- Wang C.C., Friedman L., Kennedy G.C., Wang H., Kebebew E., Steward D.L., Zeiger M.A. et al. A large multicenter correlation study of thyroid nodule cytopathology and histopathology. Thyroid. 2011 Mar. 21(3). 243-251. doi: 10.1089/thy.2010.0243.
- Bongiovanni M., Crippa S., Baloch Z., Piana S., Spitale A., Pagni F., Mazzucchelli L. et al. Comparison of 5-tiered and 6-tiered diagnostic systems for the reporting of thyroid cytopathology: a multi-institutional study. Cancer Cytopathol. 2012. 120(2). 117-125. doi: 10.1002/cncy.20195.
- Mufti S.T., Molah R. The bethesda system for reporting thyroid cytopathology: a five-year retrospective review of one center experience. Int. J. Health Sci. (Qassim). 2012 Jun. 6(2). 159-173. doi: 10.12816/0005991.

/58.jpg)