Международный эндокринологический журнал Том 17, №6, 2021
Вернуться к номеру
Нейротропні ефекти респіраторних вірусних інфекцій: ментальні та нейропсихологічні аспекти
Авторы: Шупрович А.А.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
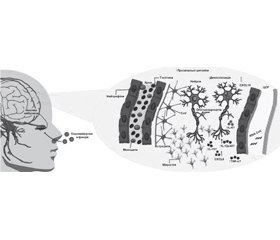
Огляд присвячений проблемі неврологічних ускладнень, які виникають внаслідок респіраторних вірусних інфекцій через ураження вірусами центральної та периферичної нервової системи. Окремо розглянуті психоневрологічні наслідки після перенесеного захворювання на COVID-19. Вірусні патогени можуть проникати до центральної нервової системи різними шляхами, зокрема через зараження ендотелію гематогенним шляхом (механізм «троянського коня»), а також через периферичні нерви або нюхові сенсорні нейрони. Останній шлях здебільшого використовують респіраторні віруси, такі як коронавіруси (CoV), які потрапляють в організм інтраназально, адже нюховий нерв з’єднує носовий епітелій із нюховою цибулиною — шляхом до центральної нервової системи. CoV у мозку людини здатні спричинити тривалі наслідки, пов’язані з розвитком або загостренням хронічних неврологічних захворювань, наприклад розсіяного склерозу. Коронавірус COVID-19, що викликає коронавірусну хворобу, вже після одужання пацієнта може призводити до довгострокових результатів, таких як психіатричні симптоми та когнітивні порушення, що виявляють за допомогою засобів когнітивного скринінгу. У постковідному періоді в пацієнтів продемонстровано погану пізнавальну діяльність у сфері уваги, виконавчих функцій та пам’яті, а також підвищений рівень депресії, тривоги, посттравматичного стресу, втоми та порушення сну. Перелічені ефекти необхідно розглядати як можливі поствірусні порушення, що потребують спеціальної діагностики та відповідного лікування. Значна неоднорідність застосованих підходів та методів перешкоджає всебічній характеристиці когнітивних функцій у конкретних сферах, оскільки дослідження часто виключали осіб із попередніми когнітивними порушеннями. Попри це більшість досліджень свідчить про певний ступінь когнітивних порушень у пацієнтів, які перехворіли на COVID-19. Незважаючи на те, що показники різняться, значна частина пацієнтів, які вижили, демонструє погану пізнавальну діяльність у сферах уваги, виконавчих функцій та пам’яті. Такі результати мають кілька важливих наслідків для подальших досліджень, клінічного ведення та лікування хворих, які перенесли COVID-19.
The review is devoted to the problem of neurological complications that result from respiratory viral infections due to viral invasion to the central and peripheral nervous systems. Psychoneurological consequences after the disease of COVID-19 are considered separately. Viral pathogens can enter the central nervous system (CNS) in various ways, including through hematogenous infection of the endothelium (the “Trojan horse” mechanism) as well as through peripheral nerves or olfactory sensory neurons. The latter route is mostly used by respiratory viruses, such as coronaviruses (CoV), which enter the body intranasally because the olfactory nerve connects the nasal epithelium with the olfactory bulb — the way to the CNS. CoV in the human brain can cause long-term effects associated with the development or exacerbation of chronic neurological diseases, such as multiple sclerosis. Coronavirus COVID-19, which causes coronavirus disease, can provoke long-term outcomes after recovery, such as psychiatric symptoms and cognitive impairment, which are detected by cognitive screening. In the post-COVID period, patients demonstrated poor cognitive performance in the areas of attention, performance, and memory as well as increased levels of depression, anxiety, post-traumatic stress, fatigue, and sleep disturbances. These effects should be considered as possible post-viral disorders that require special diagnosis and appropriate treatment. Significant heterogeneity of applied approaches and methods hinders the comprehensive characterization of cognitive functions in specific areas since the studies often excluded people with previous cognitive impairment. Nevertheless, most studies indicate some degree of cognitive impairment in patients with COVID-19. Although the rates vary, a significant proportion of survivors show poor cognitive performance in the areas of attention, performance, and memory. These results have several important implications for further research, clinical management, and treatment of those who have experienced COVID-19.
респіраторні вірусні інфекції; нейротропна активність коронавірусів; довгострокові ней-ропсихіатричні ефекти в постковідний період; когнітивні порушення; методи скринінгу
respiratory viral infections; neurotropic activity of coronaviruses; long-term neuropsychiatric effects in the post-COVID period; cognitive impairment; screening methods
Вірусні інфекції та неврологічні симптоми
Шляхи інвазії нервової системи нейротропними вірусами
Нейротропні ефекти коронавірусів та потенційні довгострокові неврологічні наслідки вірусної нейроінвазії
Нейропсихологічні та когнітивні наслідки COVID-19 та способи їх об’єктивної нейропсихологічної оцінки
Психіатричні наслідки COVID-19
Висновки
- Koyuncu O.O., I.B. Hogue, L.W. Enquist. Virus Infections in the Nervous System. Cell Host Microbe. 2013. 13(4). 379-393. doi: 10.1016/j.chom.2013.03.010.
- Bohmwald K., Gálvez N., Ríos M., Kalergis A. Neurologic Alterations Due to Respiratory Virus Infections. Front. Cell. Neurosci. 2018. 12. 386. doi: 10.3389/fncel.2018.00386.
- Nichols W.G., Peck Campbell A.J., Boeckh M. Respiratory viruses other than influenza virus: impact and therapeutic advances. Clin. Microbiol. Rev. 2008 Apr. 21(2). 274-290. doi: 10.1128/CMR.00045-07.
- Kutter J.S., Spronken M.I., Fraaij P.L., Fouchier R.A., Herfst S. Transmission routes of respiratory viruses among humans. Curr. Opin. Virol. 2018 Feb. 28. 142-151. doi: 10.1016/j.coviro.2018.01.001.
- Swanson P.A., McGavern D.B. Viral diseases of the central nervous system. Curr. Opin. Virol. 2015. 11(4). 44-54. doi: 10.1016/j.coviro.2014.12.009.
- Miner J.J., Diamond M.S. Mechanisms of restriction of viral neuroinvasion at the blood-brain barrier. Curr. Opin. Immunol. 2016 Feb. 38. 18-23. doi: 10.1016/j.coi.2015.10.008.
- Dahm T., Rudolph H., Schwerk C., Schroten H., Tenenbaum T. Neuroinvasion and Inflammation in Viral Central Nervous System Infections. Mediators Inflamm. 2016. 2016. 8562805. https://doi.org/10.1155/2016/8562805.
- Wing Y.K., Leung C.M. Mental health impact of severe acute respiratory syndrome: a prospective study Hong Kong Med. J. 2012 Aug. 18, Suppl. 3. 24-27. doi: 10.1016/j.jad.2010.04.029.
- Desforges M., Coupanec A., Dubeau P. et al. Human Coronaviruses and Other Respiratory Viruses: Underestimated Opportunistic Pathogens of the Central Nervous System? Viruses. 2019. 12(14). 1-28. doi: 10.3390/v12010014.
- Ye M., Ren Y., Lv T. Encephalitis as a clinical manifestation of COVID-19. Brain Behav. Immun. 2020. 88. 945-946. doi: 10.1016/j.bbi.2020.04.017.
- Favreau D., Meessen-Pinard M., Desforges M., Talbot P. Human coronavirus-induced neuronal programmed cell death is cyclophilin d dependent and potentially caspase dispensable. J. Virol. 2012. 86. 81-93. doi: 10.1128/JVI.06062-11.
- Vasek M., Garber C., Dorsey D. et al. A complement-microglial axis drives synapse loss during virus-induced memory impairment. Nature. 2016. 534. 538-543. doi: 10.1038/nature18283.
- Agner S., Klein R. Viruses have multiple paths to central nervous system pathology. Curr. Opin. Neurol. 2018. 31. 313-317. doi: 10.1097/WCO.0000000000000556.
- Wang T., Du Z., Zhu F. et al. Comorbidities and multiorgan injuries in the treatment of COVID-19. Lancet. 2020. 395. e52. doi: 10.1016/S0140-6736(20)30558-4. doi: 10.1136/thoraxjnl-2020-215818.
- Mandal S., Barnett J., Brill S.E. et al. ‘Long-COVID’: a cross-sectional study of persisting symptoms, biomarker and imaging abnormalities following hospitalisation for COVID-19. Thorax. 2020. 76. 396-398. doi: 10.1136/thoraxjnl-2020-215818.
- Hellmuth J., Barnett T.A., Asken B.M. et al. Persistent COVID-19-associated neurocognitive symptoms in nonhospitalized patients. J. Neurovirol. 2021. 27. 191-195. doi: 10.1007/s13365-021-00954-4.
- Beach S.R., Praschan N.C., Hogan C. et al. Delirium in COVID-19: a case series and exploration of potential mechanisms for central nervous system involvement. Gen. Hosp. Psychiatry. 2020. 65. 47-53. doi: 10.1016/j.genhosppsych.2020.05.008.
- Romero-Sánchez C.M., Díaz-Maroto I., Fernández-Díaz E. et al. Neurologic manifestations in hospitalized patients with COVID-19: The ALBACOVID registry. Neurology. 2020. 95. 1060-1070. doi: 10.1212/WNL.0000000000009937.
- Hatch R., Young D., Barber V. et al. Anxiety, Depression and Post Traumatic Stress Disorder after critical illness: a UK-wide prospective cohort study. Crit. Care. 2018. 22. 310. doi: 10.1186/s13054-018-2223-6.
- Wu Y., Xu X., Chen Z. et al. Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav. Immun. 2020. 87. 18-22. doi: 10.1016/j.bbi.2020.03.031.
- Zhou H., Lu S., Chen J. et al. The landscape of cognitive function in recovered COVID-19 patients. J. Psychiatr. Res. 2020. 129. 98-102. doi: 10.1016/j.jpsychires.2020.06.022.
- Raman B., Cassar M.P., Tunnicliffe E.M. et al. Medium-term effects of SARS-CoV-2 infection on multiple vital organs, exercise capacity, cognition, quality of life and mental health, posthospital discharge. EClinicalMedicine. 2021. 31. 100683.
- Woo M.S., Malsy J., Pöttgen J. et al. Frequent neurocognitive deficits after recovery from mild COVID-19. Brain Commun. 2020. 2. fcaa205. doi: 10.1093/braincomms/fcaa205.
- Almeria M., Cejudo J.C., Sotoca J. et al. Cognitive profile following COVID-19 infection: clinical predictors leading to neuropsychological impairment. Brain Behav. Immun. Health. 2020. 9. 100163. doi: 10.1016/j.bbih.2020.100163.
- van den Borst B., Peters J.B., Brink M. et al. Comprehensive health assessment three months after recovery from acute COVID-19. Clin. Infect. Dis. 2020. 21: ciaa1750. doi: 10.1093/cid/ciaa1750.
- Garrigues E., Janvier P., Kherabi Y. et al. Postdischarge persistent symptoms and health-related quality of life after hospitalization for COVID-19. J. Infect. 2020. 81. 4-6. doi: 10.1016/j.jinf.2020.08.029.
- Mannan A., Mehedi H.M.H., Chy N. et al. A multicentre, cross-sectional study on coronavirus disease 2019 in Bangladesh: clinical epidemiology and short-term outcomes in recovered individuals. New Microbes New Infect. 2021. 40.100838. doi: 10.1016/j.jinf.2020.08.029.
- Bowles K.H., McDonald M., Barrón Y. et al. Surviving COVID-19 after hospital discharge: symptom, functional, and adverse outcomes of home health recipients. Ann. Intern. Med. 2020. 174. 316-325. doi: 10.7326/M20-5206.
- Girard T.D., Thompson J.L., Pandharipande P.P. et al. Clinical phenotypes of delirium during critical illness and severity of subsequent long-term cognitive impairment: a prospective cohort study. Lancet Respir. Med. 2018. 6. 213-222. doi: 10.1016/S2213-2600(18)30062-6.
- Daher A., Balfanz P., C`ornelissen C. et al. Follow up of patients with severe coronavirus disease 2019 (COVID-19): pulmonary and extrapulmonary disease sequelae. Respir. Med. 2020. 174. 106197. doi: 10.1016/j.rmed.2020.106197.
- Liu D., Baumeister R.F., Veilleux J.C. et al. Risk factors associated with mental illness in hospital discharged patients infected with COVID-19 in Wuhan, China. Psychiatry Res. 2020. 292. 113297. doi: 10.1016/j.psychres.2020.113297.
- Park H.Y., Jung J., Lee S.H. et al. Psychological consequences of survivors of COVID-19 Pneumonia 1 month after discharge. J. Korean Med. Sci. 2020. 35. e409. doi: 10.3346/jkms.2020.35.e409.
- Mazza M.G., De Lorenzo R., Conte C. et al. Anxiety and depression in COVID-19 survivors: role of inflammatory and clinical predictors. Brain Behav. Immun. 2020. 89. 594-600. doi: 10.1016/j.bbi.2020.07.037.
- Speth M.M., Singer-Cornelius T., Oberle M. et al. Mood, anxiety and olfactory dysfunction in COVID-19: evidence of central nervous system involvement? Laryngoscope. 2020. 130. 2520-2525. https://doi.org/10.1002/lary.
- Zarghami A., Farjam M., Fakhraei B. et al. A report of the telepsychiatric evaluation of SARS-CoV-2 patients. Telemed J. E-Health. 2020. 26. 1461-1465. doi: 10.1089/tmj.2020.0125.
- De Lorenzo R., Conte C., Lanzani C. et al. Residual clinical damage after COVID-19: a retrospective and prospective observational cohort study. PLoS One. 2020. 15. e0239570. https://doi.org/10.1371/journal.pone.0239570.
- Huang C., Huang L., Wang Y. et al. 6-month consequences of COVID-19 in patients discharged from hospital: a cohort study. Lancet. 2021. 397. 220-232. doi: 10.1016/S0140-6736(20)32656-8.
- Cai X., Hu X., Ekumi I.O. et al. Psychological distress and its correlates among COVID-19 survivors during early convalescence across age groups. Am. J. Geriatr. Psychiatry. 2020. 28. 1030-1039. doi: 10.1016/j.jagp.2020.07.003.
- Wang P.R., Oyem P.C., Viguera A.C. Prevalence of psychiatric morbidity following discharge after COVID-19 hospitalization. Gen. Hosp. Psychiatry. 2020. 69. 131-132. doi: 10.1016/j.genhosppsych.2020.12.013.
- De Lorenzo R., Conte C., Lanzani C. et al. Residual clinical damage after COVID-19: a retrospective and prospective observational cohort study. PLoS One. 2020. 15. e0239570. https://doi.org/10.1371/journal.pone.0239570.
- de Graaf M.A., Antoni M.L., Ter Kuile M.M. et al. Short-term outpatient follow-up of COVID-19 patients: a multidisciplinary approach. EClinicalMedicine. 2021. 32. 100731. DOI: 10.1016/j.eclinm.2021.100731.
- Bonazza F., Borghi L., di San Marco E.C. et al. Psychological outcomes after hospitalization for COVID-19: data from a multidisciplinary follow-up screening program for recovered patients. Res. Psychother. 2020. 23. 491. doi: 10.4081/ripppo.2020.491.
- Bellan M., Soddu D., Balbo P.E. et al. Respiratory and psychophysical sequelae among patients with COVID-19 four months after hospital discharge. JAMA Netw Open. 2021. 4. e2036142. doi: 10.1001/jamanetworkopen.2020.36142.
- Townsend L., Dyer A.H., Jones K. et al. Persistent fatigue following SARS-CoV-2 infection is common and independent of severity of initial infection. PLoS One. 2020. 15. e0240784. doi: 10.1001/jamanetworkopen.2020.36142.
- Sykes D.L., Holdsworth L., Jawad N. et al. Post-COVID-19 symptom burden: what is long-COVID and how should we manage it? Lung. 2021. 199. 1-7. doi: 10.1007/s00408-021-00423-z.
- Islam M.S., Ferdous M.Z., Islam U.S. et al. Treatment, persistent symptoms, and depression in people infected with COVID-19 in Bangladesh. Int. J. Environ. Res. Public Health. 2021. 18. 1453. https://doi.org/10.3390/ijerph18041453.
- Di Pietro D.A., Comini L., Gazzi L., Alberto L., Vitacca M. Neuropsychological Pattern in a Series of Post-Acute COVID-19 Patients in a Rehabilitation Unit: Retrospective Analysis and Correlation with Functional Outcomes. Int. J. Environ. Res. Public Health. 2021. 18. 5917. doi: 10.3390/ijerph18115917.

/55.jpg)