Международный эндокринологический журнал Том 17, №8, 2021
Вернуться к номеру
Вплив пробіотиків та інкретиноміметиків на рівні глюкагоноподібного пептиду 1 у сироватці крові пацієнтів із цукровим діабетом 2-го типу
Авторы: Шишкань-Шишова К.О., Зінич О.В., Кушнарьова Н.М., Ковальчук А.В., Прибила О.В.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
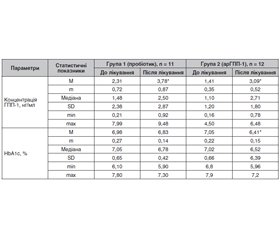
Актуальність. Захворювання на цукровий діабет (ЦД) 2-го типу характеризується порушенням ефекту інкретинів, зокрема зменшенням секреції глюкагоноподібного пептиду 1 (ГПП-1) клітинами кишкового ендотелію. Останніми десятиріччями було встановлено, що кишкова мікробіота відіграє ключову роль у регуляції багатьох метаболічних шляхів, активності імунної системи, проникності кишкового бар’єра. Було продемонстровано, що композиція бактеріальних родів у кишечнику може впливати на ефективність протидіабетичних препаратів (наприклад, метформін та агоністи рецепторів ГПП-1), яка може знижуватись за наявності дисбіозу. Тому актуальним є вивчення механізмів, які опосередковують вплив мікробіоти на секрецію інкретинів. Мета: встановлення взаємозв’язку між впливом пробіотикотерапії, інкретинотерапії та рівнем ендогенного ГПП-1 у сироватці крові пацієнтів із ЦД 2-го типу з урахуванням показників антропометрії та композиції тіла. Матеріали та методи. Обстежені 23 хворі на ЦД 2-го типу (11 жінок та 12 чоловіків). Середній вік — 56,4 ± 10,5 року (M ± SD). На початку дослідження середній рівень HbA1c становив 7,7 ± 1,5 %, усі пацієнти приймали метформін у середній добовій дозі 1500 мг/добу. Пацієнти рандомізовані на дві групи: перша група (n = 11) отримувала пробіотик, друга (n = 12) — агоніст рецепторів ГПП-1 пролонгованої дії. У хворих визначали концентрацію ГПП-1 у сироватці крові імуноферментним методом, оцінювали показники антропометрії та композицію тіла за допомогою аналізатора Tanita. Результати. У групі пацієнтів, які приймали пробіотик, спостерігалось вірогідне підвищення ГПП-1, проте менш виражено порівняно зі збільшенням рівня ГПП-1 у групі хворих, які приймали агоністи рецепторів ГПП-1. У другій групі на тлі прийому агоністів рецепторів ГПП-1 виявлене вірогідне зниження маси тіла, вмісту загального та абдомінального жиру та зменшення зневоднення. Висновки. Підвищення концентрації ендогенного ГПП-1 на тлі пробіотикотерапії вказує на можливий позитивний вплив нормалізації кишкової мікробіоти на секрецію ендогенних інкретинів. Отримані дані дають підстави припустити, що застосування комбінації пробіотика та агоністів рецепторів ГПП-1 може чинити адитивний вплив щодо гормонально-метаболічного профілю пацієнтів із ЦД 2-го типу.
Background. Type 2 diabetes mellitus is characterized by a violation of the incretin effect, in particular a decrease in the secretion of glucagon-like peptide-1 (GLP-1) by intestinal endothelial cells. In recent decades, the intestinal microbiota has been shown to play a key role in the regulation of various metabolic pathways, immune system activity, and intestinal permeability. It has been shown that the composition of bacterial genera in the intestine can unfluence the effectiveness of antidiabetic drugs (eg metformin and GLP-1 receptor agonists), which may be reduced in dysbiosis. Therefore, it is of interest to study the mechanisms that mediate the effect of microbiota on the incretin secretion. The purpose was to establish the relationship between the effects of probiotic therapy, incretin therapy and the level of endogenous GLP-1 in the serum of patients with type 2 diabetes mellitus, taking into account anthropometry and body composition. Materials and methods. We examined 23 patients with type 2 diabetes mellitus (11 women and 12 men), their average age was 56.4 ± 10.5 years (M ± SD). At the beginning of the study, the mean HbA1c level was 7.7 ± 1.5 %; all patients took metformin at an average dose of 1,500 mg/day. Patients were randomized into 2 groups: group 1 (n = 11) received a probiotic, group 2 (n = 12) — a long-acting GLP-1 receptor agonist. The concentration of GLP-1 in the blood serum was determined by the enzyme-linked immunosorbent assay, anthropometry parameters and body composition were assessed using the Tanita analyzer. Results. In the group of patients who took the probiotic, a significant increase in GLP-1 was observed, but less pronounced compared to an increase in GLP-1 level in the group of patients who took GLP-1 receptor agonists. In group 2, on the background of taking GLP-1 receptor agonists, a significant decrease in body weight, total and abdominal fat content, and a decrease in dehydration were revealed. Conclusions. An increase in the concentration of endogenous GLP-1 against the background of probiotic therapy indicates a possible positive effect of normalization of the intestinal microbiota on the secretion of endogenous incretins. The results obtained suggest that the use of a combination of probiotic and GLP-1 receptor agonists may have an additive effect on the hormonal and metabolic profile in patients with type 2 diabetes mellitus.
цукровий діабет 2-го типу; глюкагоноподібний пептид 1; кишкова мікробіота; пробіотики; інкретиноміметики; композиція тіла
type 2 diabetes mellitus; glucagon-like peptide-1; intestinal microbiota; probiotics; incretine mimetics; body composition
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Garber A.J., Handelsman Y., Grunberger G., Einhorn D., Abrahamson M.J., Barzilay J.I., Blonde L. et al. Consensus statement by the American Association of Clinical Endocrinologists and American College of Endocrinology on the comprehensive type 2 diabetes management algorithm — 2020 executive summary. Endocr. Pract. 2020 Jan. 26(1). 107-139. doi: 10.4158/CS-2019-0472. PMID: 32022600.
- Kahn S.E., Haffner S.M., Heise M.A., Herman W.H., Holman R.R., Jones N.P., Kravitz B.G. et al. ADOPT Study Group. Glycemic durability of rosiglitazone, metformin, or glyburide monotherapy. N. Engl. J. Med. 2006, Dec 7. 355(23). 2427-43. doi: 10.1056/NEJMoa066224.
- Riedel A.A., Heien H., Wogen J., Plauschinat C.A. Secondary failure of glycemic control for patients adding thiazolidinedione or sulfonylurea therapy to a metformin regimen. Am. J. Manag. Care. 2007. 13. 457-463. PMID: 17685826.
- Zhang Q., Hu N. Effects of Metformin on the Gut Microbiota in Obesity and Type 2 Diabetes Mellitus. Diabetes Metab. Syndr. Obes. 2020. 13. 5003-5014 https://doi.org/10.2147/DMSO.S286430.
- Aydin Ö., Nieuwdorp M., Gerdes V. The gut microbiome as a target for the treatment of type 2 diabetes. Curr. Diab. Rep. 2018. 18(8). 55. doi: 10.1007/s11892-018-1020-6.
- Fan Y., Pedersen O. Gut microbiota in human metabolic health and disease. Nat. Rev. Microbiol. 2021. 19. 55-71. https://doi.org/10.1038/s41579-020-0433-9.
- Harsch I.A., Konturek P.C. The role of gut microbiota in obesity and type 2 and type 1 diabetes mellitus: new insights into “Old” diseases. MedSci. 2018. 6(2). 32. doi: 10.3390/medsci6020032.
- Proal A., Lindseth I., Marshall T. Microbe-Microbe and Host-Microbe Interactions Drive Microbiome Dysbiosis and Inflammatory Processes. Discovery Medicine. 2017 Jan. 23(124). 51-60. PMID: 28245427.
- Rattarasarn C. Dysregulated lipid storage and its relationship with insulin resistance and cardiovascular risk factors in non-obese Asian patients with type 2 diabetes. Adipocyte. 2018. 7(2). 71-80. doi: 10.1080/21623945.2018.1429784.
- Tanase D.M., Gosav E.M., Neculae E., Costea C.F., Ciocoiu M., Hurjui L.L., Tarniceriu C.C. et al. Role of Gut Microbiota on Onset and Progression of Microvascular Complications of Type 2 Diabetes (T2DM). Nutrients. 2020, Dec 2. 12(12). 3719. doi: 10.3390/nu12123719.
- Shen J., Obin M., Zhao L. The gut microbiota, obesity and insulin resistance. Mol. Aspects Med. 2013 Feb. 34(1). 39-58. doi: 10.1016/j.mam.2012.11.001.
- Thursby E., Juge N. Introduction to the human gut microbiota. Biochem. J. 2017. 474(11). 1823-1836. doi: 10.1042/BCJ20160510.
- Herrema H., Niess J.H. Intestinal microbial metabolites in human metabolism and type 2 diabetes. Diabetologia. 2020. 63(12). 2533-2547. doi: 10.1007/s00125-020-05268-4.
- Wang Y., Dilidaxi D., Wu Y., Sailike J., Sun X., Nabi X.H. Composite probiotics alleviate type 2 diabetes by regulating intestinal microbiota and inducing GLP-1 secretion in db/db mice. Biomed Pharmacother. 2020 May. 125. 109914. doi: 10.1016/j.biopha.2020.109914.
- Yamane S., Inagaki N. Regulation of glucagon-like peptide-1 sensitivity by gut microbiota dysbiosis. J. Diabetes Investig. 2018 Mar. 9(2). 262-264. doi: 10.1111/jdi.12762.
- Greenhill C. Effects of metformin mediated by gut microbiota. Nat. Rev. Endocrinol. 2019 Dec. 15(1). 2. doi: 10.1038/s41574-018-0133-y.
- Iulia-Suceveanu A., Micu S., Voinea C., Manea M., Catrinoiu D. et al. Metformin and Its Benefits in Improving Gut Microbiota Disturbances in Diabetes Patients [Online First]. IntechOpen. 2019 Oct. doi: 10.5772/intechopen.88749.
- Hung W.C., Hung W.-W. 1159-P: Metformin Monotherapy Changes Gut Microbiota in Newly Diagnosed Type 2 Diabetes. Diabetes 2019 Jun. 68(1). https://doi.org/10.2337/db19-1159-P.
- Ouyang J., Isnard S., Lin J. et al. Metformin effect on gut microbiota: insights for HIV-related inflammation. AIDS Res. Ther. 2020, Mar 10. 17(1). 10. doi: 10.1186/s12981-020-00267-2.
- Pascale A., Marchesi N., Govoni S., Coppola A., Gazzaruso C. The role of gut microbiota in obesity, diabetes mellitus, and effect of metformin: new insights in toold diseases. Curr. Opin. Pharmacol. 2019 Dec. 49. 1-5. doi: 10.1016/j.coph.2019.03.011.
- American Diabetes Association. Standards of Medical Care in Diabetes — 2020. 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Medical Care in Diabetes — 2020 Jan. 43 (Suppl. 1). 98-110. https://doi.org/10.2337/dc20-S009.
- Nauck M., Meier J. Incretin hormones: their role in health and disease. Diabetes Obes. Metab. 2018. 20(Suppl. 1). 5-21. doi: 10.1111/dom.13129.
- Sokolova L.K., Belchina Yu.B., Pushkarev V.V., Cherviakova S.A., Vatseba T.S., Kovzun O.I., Pushkarev V.M., Tronko M.D. The effect of metformin treatment on the level of GLP-1, NT-proBNP and endothelin-1 in patients with type 2 diabetes mellitus. International Journal of Endocrinology (Ukraine). 2020. 16(8). 616-621. doi: https://doi.org/10.22141/2224-0721.16.8.2020.222882.
- Zhao L., Chen Y., Xia F., Abudukerimu B., Zhang W., Guo Y., Wang N., Lu Y. A Glucagon-Like Peptide-1 Receptor Agonist Lowers Weight by Modulating the Structure of Gut Microbiota. Front. Endocrinol (Lausanne). 2018, May 17. 9. 233. doi: 10.3389/fendo.2018.00233.
- Adeshirlarijaney A., Gewirtz A. Considering gut microbiota in treatment of type 2 diabetes mellitus. Gut. Microbes. 2020. 11(3). 253-264. doi: 10.1080/19490976.2020.1717719.
- Madsen M.S.A., Holm J.B., Pallejà A. et al. Metabolic and gut microbiome changes following GLP-1 or dual GLP-1/GLP-2 receptor agonist treatment in diet-induced obese mice. Sci. Rep. 2019. 9. 15582 (2019). https://doi.org/10.1038/s41598-019-52103-x.
- Montandon S., Jornayvaz F. Effects of Antidiabetic Drugs on Gut Microbiota Composition. Genes (Basel). 2017 Oct. 8(10). 250. doi: 10.3390/genes8100250.
- Ejtahed S., Mohtadi-Nia J., Homayouni-Rad A. et al. Probiotic yogurt improves antioxidant status in type 2 diabetic patients. Nutrition. 2012. 5. 539-543. doi: 10.1016/j.nut.2011.08.013.
- Shi X., Zhou F., Li X. et al. Central GLP-2 enhances hepatic insulin sensitivity via activating PI3K signaling in POMC neurons. Cell. Metab. 2013. 18(1). 86-98. doi: 10.1016/j.cmet.2013.06.014.
- Gerritsen J., Smidt H., Rijkers G., de Vos W. Intestinal microbiota in human health and disease: the impact of probiotics. Genes. Nutr. 2011. 6. № 3. 209-240. doi: 10.1007/s12263-011-0229-7.
- Roberfroid M., Gibson G.R., Hoyles L., McCartney A.L., Rastall R., Rowland I., Wolvers D. et al. Prebiotic effects: metabolic and health benefits. Br. J. Nutr. 2010 Aug. 104, Suppl. 2. 1-63. doi: 10.1017/S0007114510003363. PMID: 20920376.
- He M., Shi B. Gut microbiota as a potential target of metabolic syndrome: the role of probiotics and prebiotics. Cell. Biosci. 2017. 7. 54. doi: 10.1186/s13578-017-0183-1.
- Takemura N., Okubo T., Sonoyama K. Lactobacillus plantarum strain No. 14 reduces adipocyte size in mice fed high-fat diet. Exp. Biol. Med. (Maywood). 2010. 235(7). 849-856. doi: 10.1258/ebm.2010.009377.
- Nathalie M. Delzenne, Audrey M. Neyrinck and Patrice D. Cani Br. J. Nutr. 2013. 109(Suppl. 2). 81-5. doi: 10.1017/S0007114512004047.
- Parnell J.A., Reimer R. Weight loss during oligofructose supplementation is associated with decreased ghrelin and increased peptide YY in overweight and obese adults . Am. J. Clin. Nutr. 2009. 89(6). 1751-1759. doi: 10.3945/ajcn.2009.27465.
- Genta S., Cabrera W., Habib N., Pons J., Carillo I.M., Grau A., Sánchez S. Yacon syrup: beneficial effects on obesity and insulin resistance in humans. Clin. Nutr. 2009 Apr. 28(2). 182-7. doi: 10.1016/j.clnu.2009.01.013.
- Cani P.D., Lecourt E., Dewulf E.M., Sohet F.M., Pachikian B.D., Naslain D., De Backer F. et al. Gut microbiota fermentation of prebiotics increases satietogenic and incretin gut peptide production with consequences for appetite sensation and glucose response after a meal. Am. J. Clin. Nutr. 2009. 90(5). 1236-43. doi: 10.3945/ajcn.2009.28095.
- Honda К., Saneyasu T., Hasegawa S. et al. Effect of Licorice flavonoid oil on cholesterol metabolism in high fat diet rats. Biosci. Biotechnol. Biochem. 2013. 77(6). 1326-1328. doi: 10.1271/bbb.130104.
- Everard A., Cani P. Gut microbiota and GLP-1. Rev. Endocr. Metab. Disord. 2014. 15(3). 189-196. doi: 10.1007/s11154-014-9288-6.
- Mahboobi S., Rahimi F., Jafarnejad S. Effects of Prebiotic and Synbiotic Supplementation on Glycaemia and Lipid Profile in Type 2 Diabetes: A Meta-Analysis of Randomized Controlled Trials. Adv. Pharm. Bull. 2018 Nov. 8(4). 565-574. doi: 10.15171/apb.2018.065.
- Chung H., Cesari M., Anton S. et al. Molecular inflammation: underpinnings of aging and age-related diseases. Ageing Res. Rev. 2009. 8(1). 18-30. doi: 10.1016/j.arr.2008.07.002.
- Schiffrin E.J., Thomas D., Kumar V. et al. Systemic inflammatory markers in older persons: the effect of oral nutritional supplementation with prebiotics. J. Nutr. Health Aging. 2007. 11(6). 475-9. PMID: 17985062.
- Lee A.Y.H., Chappell D.L., Bak M.J. Multiplexed quantification of proglucagon-derived peptides by immunoaffinity enrichment and tandem mass spectrometry after a meal tolerance test. Clin. Chem. 2016. 62(1). 227-235. https://doi.org/10.1373/clinchem.2015.244251.
- Mazur О.О., Plaksyvyi О.H., Pashkovska N.V., Bilooka I.O. State of the large intestine microbiota in patients with type 1 diabetes mellitus depending on the severity of clinical course. Міжнародний ендокринологічний журнал. 2016. 5(77). 61-66. doi: 10.22141/2224-0721.5.77.2016.78756.
- Knudsen L.B. Inventing Liraglutide, a Glucagon-Like Peptide-1 Analogue, for the Treatment of Diabetes and Obesity. ACS Pharmacology & Translational Science. 2019. 2(6). 468-484. https://doi.org/10.1021/acsptsci.9b00048.

/23.jpg)
/24.jpg)