Международный эндокринологический журнал Том 18, №4, 2022
Вернуться к номеру
Продукт метаболічної активності кишкового мікробіому триметиламін-N-оксид (ТМАО) — біомаркер прогресування атеросклерозу й серцево-судинних ускладнень у хворих на цукровий діабет 2-го типу
Авторы: Шишкань-Шишова К.О., Зінич О.В.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
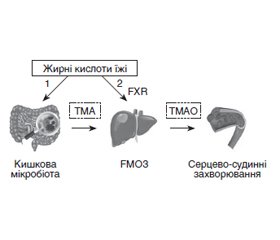
Проаналізовані дані літератури про значення кишкової мікробіоти як ендокринного органа — продуцента біологічно активних метаболітів, які виконують ключові функції для підтримки метаболічного гомеостазу всього організму, зокрема стану серцево-судинної системи. Клінічними та експериментальними дослідженнями з використанням метаболомічного підходу встановлено, що розвиток атеросклеротичних серцево-судинних захворювань часто асоціюється з підвищеним рівнем одного з мікробіальних метаболітів — триметиламін-N-оксиду (ТМАО). ТМАО може бути чутливим прогностичним біомаркером розвитку ускладнень цукрового діабету 2-го типу (ЦД2), зокрема атеросклерозу та серцево-судинних захворювань. Попередником ТМАО є триметиламін (ТМА), утворюваний кишковими бактеріями з харчового фосфатидилхоліну та L-карнітину. У печінці триметиламін перетворюється на триметиламін-N-оксид під впливом печінкової флавінмонооксигенази 3. До механізмів проатерогенного ефекту підвищених рівнів ТМАО належать вплив на метаболізм жовчних кислот і холестерину, гіперактивація тромбоцитів, стимуляція запальних процесів та оксидативного стресу, що викликає ендотеліальну дисфункцію, кальцифікацію судин, сприяє піноутворенню макрофагів, а також індукує стрес ендоплазматичного ретикулуму. Встановлено, що TMAO, за умов хронічного підвищення рівня, може сприяти кардіометаболічним захворюванням. Припускають, що підвищення рівня ТМАО при дисметаболічних станах (ожирінні, ЦД2, атеросклерозі або ішемічній хворобі серця) значною мірою пов’язане з профілем мікробіоти кишечника. Тому регулювання співвідношення кишкових мікроорганізмів або їх здатності до утворення попередника ТМАО — ТМА може бути шляхом до розробки нових засобів профілактики та лікування атеросклерозу та запобігання прогресуванню серцево-судинних ускладнень, у тому числі у хворих на ЦД2. Дослідження продемонстрували, що інгібування різних етапів продукції ТМАО може знизити рівень ТМАО та сприяти лікуванню атеросклерозу та цукрового діабету.
The literature data on the importance of intestinal microbiota as an endocrine organ — producer of biologically active metabolites, which perform key functions to maintain metabolic homeostasis of the whole organism, in particular the condition of the cardiovascular system, are analyzed. Clinical and experimental studies using a metabolomical approach have shown that the development of atherosclerotic CVD is often associated with elevated levels of one of the microbial metabolites, trimethylamine N-oxide (TMAO). TMAO may be a sensitive prognostic biomarker of complications of type 2 diabetes, including atherosclerosis and cardiovascular disease. The precursor of TMAO is trimethylamine (TMA), formed by intestinal bacteria from food phosphatidylcholine and L-carnitine. In the liver, TMA is converted to TMAO under the influence of hepatic flavin monooxygenase 3. The mechanisms of the proatherogenic effect of elevated levels of TMAO include effects on bile acid and cholesterol metabolism, platelet hyperactivation, stimulation of inflammatory processes and oxidative stress, induction of endothelial disfunction and endoplasmic reticulum stress. It has been established that TMAO, in conditions of chronic elevation, can contribute to cardiometabolic diseases. Elevated levels of TMAO in dysmetabolic conditions (obesity, type 2 diabetes, atherosclerosis, or coronary heart disease) have been suggested to be largely associated with the gut microbiota profile. Therefore, regulating the ratio of intestinal microorganisms or their ability to form a precursor of TMAO — TMA, may be a way to develop new tools for the prevention and treatment of atherosclerosis and prevent the progression of cardiovascular complications, including in patients with type 2 diabetes. Studies have shown that inhibiting various stages of TMAO production can reduce TMAO levels and help treat atherosclerosis and diabetes.
метаболіти кишкової мікробіоти; триметиламін-N-оксид (ТМАО); механізми атерогенної дії; біомаркер кардіометаболічних ускладнень цукрового діабету 2-го типу; огляд
intestinal microbiota metabolites; trimethylamine-N-oxide (TMAO); mechanisms of atherogenic action; biomarker of cardiometabolic complications of type 2 diabetes mellitus; review
Зміни складу кишкової мікробіоти при дисметаболічних станах
Молекулярні механізми метаболічних ефектів кишкової мікробіоти
Триметиламін-N-оксид: мікробіальний метаболіт — біомаркер ризику ССЗ
Метаболізм ТМАО
/35.jpg)
Біомаркери та чинники розвитку ССЗ, пов’язані з мікробіальними метаболітами
Молекулярні механізми атерогенних ефектів ТМАО
Стрес ендоплазматичного ретикулуму
- Martin-Gallausiaux C., Marinelli L., Blottière H. et al. SCFA: mechanisms and functional importance in the gut. Proceedings of the Nutrition Society. 2021. 80(1). 37-49. doi: 10.1017/S0029665120006916.
- Ma Q., Li Y., Li P., Wang M., Wang J. et al. Research progress in the relationship between type 2 diabetes mellitus and intestinal flora. Biomed. Pharmacother. 2019. 117. 109138. doi: 10.1016/j.biopha.2019.109138.
- Ma Q., Xing C., Long W. et al. Impact of microbiota on central nervous system and neurological diseases: the gut-brain axis. J. Neuroinflammation. 2019. 16(1). 53. doi: 10.1186/s12974-019-1434-3.
- Di Marzo V., Silvestri C. Lifestyle and metabolic syndrome: Contribution of the endocannabinoidome. Nutrients. 2019. 11(8). 1956. doi: 10.3390/nu11081956.
- Noce A., Marrone G., Di Daniele F., Ottaviani E., Wilson Jones G., Bernini R. et al. Impact of gut microbiota composition on onset and progression of chronic non-communicable diseases. Nutrients. 2019. 11(5). 1073. doi: 10.3390/nu11051073.
- WHO Global NCD Action Plan 2013-2020. Global Action Plan for the Prevention and Control of NCDs 2013–2020 (resolution WHA66.10). https://www.who.int/publications/i/item/9789241506236.
- Sun H., Saeedi Р., Karuranga S., Pinkepank M., Ogurtsova K., Duncan B.В. et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res. Clin. Pract. 2022. 183. 109119. doi: 10.1016/j.diabres.2021.109119.
- O’Donnell M.J., Chin S.L., Rangarajan S., Xavier D., Liu L., Zhang H. et al. Global and regional effects of potentially modifiable risk factors associated with acute stroke in 32 countries (INTERSTROKE): a case-control study. Lancet. 2016. 388(10046). 761-75. doi: 10.1016/S0140-6736(16)30506-2.
- Larin O.S., Tkach S.M., Tymoshenko O.S. et al. Pathogenetic role of intestinal dysbiosis in the development of obesity and type 2 diabetes. Clinical Endocrinology and Endocrine Surgery. 2016. 3 (55). 82-90. DOI: https://doi.org/10.24026/1818-1384.3(55).2016.77658. (in Ukrainian)
- Karlsson F., Tremaroli V., Nookaew I. et al. Gut metagenome in European women with normal, impaired and diabetic glucose control. Nature. 2013. 498(7452). 99-103. doi: 10.1038/nature12198.
- Larsen N., Vogensen F., Van Den Berg F. et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults. PloS One. 2010. 5(2). e9085. doi: 10.1371/journal.pone.0009085.
- Zhang X., Shen D., Fang Z. et al. Human gut microbiota changes reveal the progression of glucose intolerance. PloS Оne. 2013. 8(8). e71108. doi: 10.1371/journal.pone.0071108.
- Masenga S.К., Hamooya B., Hangoma J. et al. Recent advances in modulation of cardiovascular diseases by the gut microbiota. J. Hum. Hypertens. 2022. https://doi.org/10.1038/s41371-022-00698-6.
- Karlsson F., Fak F., Nookaew I., Tremaroli V., Fagerberg B., Petranovic D. et al. Symptomatic atherosclerosis is associated with an altered gut metagenome. Nat. Commun. 2012. 3. 1245. doi: 10.1038/ncomms2266.
- van den Munckhof I., Kurilshikov A., Ter Horst R., Riksen N.P., Joosten L.А.В., Zhernakova A. et al. Role of gut microbiota in chronic low-grade inflammation as potential driver for atherosclerotic cardiovascular disease: a systematic review of human studies. Obes. Rev. 2018. 19(12). 1719-1734. doi: 10.1111/obr.12750.
- Zhang X., Gérard P. Diet-gut microbiota interactions on cardiovascular disease. Comput. Struct. Biotechnol. J. 2022. 20. 1528-1540. doi: 10.1016/j.csbj.2022.03.028.
- Bergeron N., Williams P., Lamendella R., Faghihnia N., Grube A., Li X. et al. Diets high in resistant starch increase plasma levels of trimethylamine-N-oxide, a gut microbiome metabolite associated with CVD risk. Br. J. Nutr. 2016 Dec. 116(12). 2020-2029. doi: 10.1017/S0007114516004165.
- Li J., Lin S., Vanhoutte P., Woo C., Xu A. Akkermansia muciniphila protects against atherosclerosis by preventing metabolic endotoxemia-induced inflammation in Apoe–/– mice. Circulation. 2016 Jun 14. 133(24). 2434-46. doi: 10.1161/CIRCULATIONAHA.115.019645.
- Ma J., Li H. The role of gut microbiota in atherosclerosis and hypertension. Front. Pharmacol. 2018 Sep 25. 9. 1082. doi: 10.3389/fphar.2018.01082.
- Falalyeyeva T., Mamula Y., Scarpellini E., Leshchenko I., Humeniuk A., Pankiv I., Kobyliak N. Probiotics and obesity associated disease: an extended view beyond traditional strains. Minerva Gastroenterology. 2021. 67(4). 348-356. DOI: 10.23736/S2724-5985.21.02909-0.
- Wexler A.G., Goodman A.L. An insider’s perspective: Bacteroides as a window into the microbiome. Nat. Microbiol. 2017 Apr 25. 2. 17026. doi: 10.1038/nmicrobiol.2017.26.
- Jie Z., Xia H., Zhong S.L., Feng Q., Li S., Liang S. et al. The gut microbiome in atherosclerotic cardiovascular disease. Nat. Commun. 2017. 8(1). 845. doi: 10.1038/s41467-017-00900-1.
- Cui X., Ye L., Li J., Jin L. Metagenomic and metabolomic analyses unveil dysbiosis of gut microbiota in chronic heart failure patients. Sci Rep. 2018. 8(1). 635. doi: 10.1038/s41598-017-18756-2.
- Kasubuchi M., Hasegawa S., Hiramatsu T., Ichimura A., Kimura I. Dietary gut microbial metabolites, short-chain fatty acids, and host metabolic regulation. Nutrients. 2015. 7(4). 2839-49. doi: 10.3390/nu7042839.
- Perry R., Peng L., Barry N., Cline G., Zhang D., Cardone R., Petersen K. et al. Acetate mediates a microbiome — brain — β-cell axis to promote metabolic syndrome. Nature. 2016. 534(7606). 213-7. doi: 10.1038/nature18309.
- Jia W., Xie G., Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis. Nat. Rev. Gastroenterol. Hepatol. 2018. 15(2). 111-128. doi: 10.1038/nrgastro.2017.119.
- Boutagy N.E., McMillan R.Р., Frisard M.І., Hulver M.W. Metabolic endotoxemia with obesity: Is it real and is it relevant? Biochimie. 2016. 124. 11-20. doi: 10.1016/j.biochi.2015.06.020.
- Potrykus M., Szymański M., Kaska Ł., Janczy A. Intestinal barrier disorders and metabolic endotoxemia in obesity: Current knowledge. Postępy Higieny i Medycyny Doświadczalnej. 2022. 76(1). 71-80. https://doi.org/10.2478/ahem-2022-0008.
- Naghipour S., Cox A., Peart J., Du Toit E., Headrick J. Trimethylamine N-oxide: Heart of the microbiota — CVD nexus? Nutrtion Res. Rev. 2021. 34(1). 125-146. doi: 10.1017/S0954422420000177.
- He M., Tan C.Р., Xu Y.J., Liu Y. Gut microbiota-derived trimethylamine-N-oxide: A bridge between dietary fatty acid and cardiovascular disease? Food Res. Int. 2020. 138(Pt B). 109812. doi: 10.1016/j.foodres.2020.109812.
- Wang Z., Tang W., Buffa J., Fu X., Britt E., Koeth R. et al. Prognostic value of choline and betaine depends on intestinal microbiota-generated metabolite trimethylamine-N-oxide. Eur. Heart J. 2014. 35 (14). 904-910. Doi: 35 904-910.10.1093/eurheartj/ehu002.
- Miao J., Ling A., Manthena P., Gearing M., Graham M., Crooke R. et al. Flavin-containing monooxygenase 3 as a potential player in diabetes-associated atherosclerosis. Nat. Commun. 2015. 6. 6498. Doi: 10.1038/ncomms7498.
- Shih D., Wang Z., Lee R., Meng Y., Che N., Charugundla S. et al. Flavin containing monooxygenase 3 exerts broad effects on glucose and lipid metabolism and atherosclerosis. J. Lipid Res. 2015. 56 (1). 22-37. doi: 10.1194/jlr.M051680.
- Brown J., Hazen S.L. The gut microbial endocrine organ: bacterially derived signals driving cardiometabolic diseases. Annu. Rev. Med. 2015. 66. 343-359. doi: 10.1146/annurev-med-060513-093205.
- Wang Q., Guo M., Liu Y., Xu M., Shi L., Li X. et al. Bifidobacterium breve and Bifidobacterium longum attenuate choline-induced plasma trimethylamine n-oxide production by modulating gut microbiota in mice. Nutrients. 2022. 14(6). 1222. doi: 10.3390/nu14061222.
- Wang B., Qiu J., Lian J., Yang X., Zhou J. Gut Metabolite Trimethylamine-N-Oxide in Atherosclerosis: From mechanism to therapy. Front. Cardiovasc. Med. 2021. 8. 723886. https://doi.org/10.3389/fcvm.2021.723886.
- Amrein M., Li X., Walter J., Wang Z., Zimmermann T., Strebel I. et al. Gut microbiota-dependent metabolite trimethylamine N-oxide (TMAO) and cardiovascular risk in patients with suspected functionally relevant coronary artery disease (fCAD). Clinical Research in Cardiology. 2022. 1-13. https://doi.org/10.1007/s00392-022-01992-6.
- Mohan V., George M. A Review of The Contribution of Gut-Dependent Microbiota Derived Marker, Trimethylamine N-oxide (TMAO), in Coronary Artery Disease. Curr. Res. Nutr. Food Sci. 2021. 9(3). doi: http://dx.doi.org/10.12944/CRNFSJ.9.3.01.
- Troseid M., Ueland T., Hov J.R., Svardal A., Gregersen I., Dahl C.P. et al. Microbiota-dependent metabolite trimethylamine-N-oxide is associated with disease severity and survival of patients with chronic heart failure. J. Int. Med. 2015. 277 (6). 717-726. doi: 10.1111/joim.12328.
- Koeth R., Levison B., Culley M., Buffa J., Wang Z., Gregory J. et al. gamma-butyrobetaine is a proatherogenic intermediate in gut microbial metabolism of L-carnitine to TMAO. Cell Metab. 2014 Nov 4. 20(5). 799-812. doi: 10.1016/j.cmet.2014.10.006.
- Chen K., Zheng X., Feng M., Li D., Zhang H. Gut microbiota-dependent metabolite trimethylamine n-oxide contributes to cardiac dysfunction in western diet-induced obese mice. Front. Physiol. 2017 Mar 21. 8.139. doi: 10.3389/fphys.2017.00139.
- Guasch-Ferre M., Hu F., Ruiz-Canela M., Bullo M., Toledo E., Wang D. et al. Plasma metabolites from choline pathway and risk of cardiovascular disease in the PREDIMED (Prevention With Mediterranean Diet) Study. J. Am. Heart Assoc. 2017 Oct 28. 6(11). e006524. doi: 10.1161/JAHA.117.006524.
- Wang Z., Klipfell E., Bennett B., Koeth R., Levison B., Dugar B. et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature. 2011 Apr 7. 472(7341). 57-63. doi: 10.1038/nature09922.
- Lee Y., Nemet I., Wang Z., Lai H., de Oliveira Marcia C. Otto et al. Longitudinal plasma measures of trimethylamine n-oxide and risk of atherosclerotic cardiovascular disease events in community-based older adults. Journal of the American Heart Association. 2021. 10(17). e020646. doi.org/10.1161/JAHA.120.020646.
- Li X.S., Obeid S., Wang Z. et al. Trimethyllysine, a trimethylamine N-oxide precursor, provides near- and long-term prognostic value in patients presenting with acute coronary syndromes. Eur. Heart J. 2019 Aug 21. 40(32). 2700-2709. doi: 10.1093/eurheartj/ehz259.
- Schiattarella G.G., Sannino A., Toscano E. et al. Gut microbe-generated metabolite trimethylamine-N-oxide as cardiovascular risk biomarker: a systematic review and dose-response meta-analysis. Eur. Heart J. 2017 Oct 14. 38(39). 2948-2956. doi: 10.1093/eurheartj/ehx342.
- Farhangi M.А., Vajdi M., Asghari-Jafarabadi M. Gut microbiota-associated metabolite trimethylamine N-Oxide and the risk of stroke: a systematic review and dose-response meta-analysis. Nutr. J. 2020 Jul 30. 19(1). 76. doi: 10.1186/s12937-020-00592-2.
- Farhangi M.A. Gut microbiota-dependent trimethylamine N-oxide and all-cause mortality: findings from an updated systematic review and meta-analysis. Nutrition. 2020. 78. 110856. doi: 10.1016/j.nut.2020.110856.
- Heianza Y., Ma W., DiDonato J.А., Sun Q., Rimm E.В., Hu F.В. et al. Long-term changes in gut microbial metabolite trimethylamine N-oxide and coronary heart disease risk. J. Am. Coll. Cardiol. 2020 Feb 25. 75(7). 763-772. doi: 10.1016/j.jacc.2019.11.060.
- Senthong V., Kiatchoosakun S., Wongvipaporn C. et al. Gut microbiota-generated metabolite, trimethylamine-N-oxide, and subclinical myocardial damage: a multicenter study from Thailand. Scientific Reports. 2021. 11. 14963. doi.org/10.1038/s41598-021-93803-7.
- Amarasekera A.Т., Chang D. Buddhist meditation for vascular function: a narrative review. Integr. Med. Res. 2019 Dec. 8(4). 252-256. doi: 10.1016/j.imr.2019.11.002.
- Hoevenaars F., van der Kamp J.W., van den Brink W., Wopereis S. Next generation health claims based on resilience: the example of whole-grain wheat. Nutrients. 2020 Sep 25. 12(10). 2945. doi: 10.3390/nu12102945.
- Chen H., Li J., Li N., Liu H., Tang J. Increased circulating trimethylamine N-oxide plays a contributory role in the development of endothelial dysfunction and hypertension in the RUPP rat model of preeclampsia. Hypertens Pregnancy. 2019 May. 38(2). 96-104. doi: 10.1080/10641955.2019.1584630.
- Mills S., Stanton C., Lane J.А., Smith G.J., Ross R.P. Precision nutrition and the microbiome, part I: current state of the science. Nutrients. 2019 Apr 24. 11(4). 923. doi: 10.3390/nu11040923.
- Abbasian N. Vascular calcification mechanisms: updates and renewed insight into signaling pathways involved in high phosphate-mediated vascular smooth muscle cell calcification. Biomedicines. 2021 Jul 12. 9(7). 804. doi: 10.3390/biomedicines9070804.
- Lin H., Liu T., Li X., Gao X., Wu T., Li P. The role of gut microbiota metabolite trimethylamine N-oxide in functional impairment of bone marrow mesenchymal stem cells in osteoporosis disease. Ann. Transl. Med. 2020 Aug. 8(16). 1009. doi: 10.21037/atm-20-5307.
- Cai J., Zhang M., Liu Y., Li H., Shang L., Xu T. et al. Iron accumulation in macrophages promotes the formation of foam cells and development of atherosclerosis. Cell Biosci. 2020 Nov 26. 10(1). 137. doi: 10.1186/s13578-020-00500-5.
- Holme S., Sigsgaard T., Holme J., Holst G. Effects of particulate matter on atherosclerosis: a link via high-density lipoprotein (HDL) functionality? Particle and Fibre Toxicology. 2020. 17. 36. doi: 10.1186/s12989-020-00367-x.
- Mazur О., Plaksyvyi О., Pashkovska N., Bilooka І. State of the Large Intestine Microbiota in Patients with Type 1 Diabetes Mellitus Depending on the Severity of Clinical Course. International Journal of Endocrinology (Ukraine). 2016. 5(77). 61-66. https://doi.org/10.22141/2224-0721.5.77.2016.78756
- Jaworska K., Hering D., Mosieniak G., Bielak-Zmijewska A., Pilz M., Konwerski M., et al. TMA, a forgotten uremic toxin, but not TMAO, is involved in cardiovascular pathology. Toxins (Basel). 2019 Aug 26. 11(9). 490. doi: 10.3390/toxins11090490.
- Li J., Zeng Q., Xiong Z., Xian G., Liu Z., Zhan Q. et al. Trimethylamine-N-oxide induces osteogenic responses in human aortic valve interstitial cells in vitro and aggravates aortic valve lesions in mice. Cardiovasc. Res. 2021. cvab 243. doi: 10.1093/cvr/cvab243.
- Zhu W., Gregory J.C., Org E., Buffa J.A., Gupta N., Wang Z. et al. Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk. Cell. 2016. 165(1). 111-124. doi: 10.1016/j.cell.2016.02.011.
- Witkowski M., Witkowski М., Friebel J., Buffa J.А. Li X.S., Wang Z. et al. Vascular endothelial Tissue Factor contributes to trimethylamine N-oxide-enhanced arterial thrombosis. Cardiovasc. Res. 2021. cvab263. doi: 10.1093/cvr/cvab263.
- Vinchi F. Thrombosis prevention: let’s drug the microbiome! Hemasphere. 2019. 3(1). e165. doi: 10.1097/HS9.0000000000000165.
- Li Y., Xu Y., Jadhav K., Zhu Y., Yin L., Zhang Y. Hepatic forkhead box protein A3 regulates ApoA-I (apolipoprotein A-I) expression, cholesterol efflux, and atherogenesis. Arterioscler. Thromb. Vasc. Biol. 2019. 39(8). 1574-1587. doi: 10.1161/ATVBAHA.119.312610.
- Ding L., Chang M., Guo Y., Zhang L., Xue C., Yanagita T. et al. Trimethylamine-N-oxide (TMAO)-induced atherosclerosis is associated with bile acid metabolism. Lipids Health Dis. 2018. 17(1). 286. doi: 10.1186/s12944-018-0939-6.
- He Z., Hao W., Kwek E., Lei L., Liu J., Zhu H. et al. Fish oil is more potent than flaxseed oil in modulating gut microbiota and reducing trimethylamine-N-oxide-exacerbated atherogenesis. J. Agric. Food Chem. 2019. 67(49). 13635-13647. doi: 10.1021/acs.jafc.9b06753.
- Lim T., Ryu J., Lee K., Park S.Y., Hwang K.T. Protective effects of black raspberry (Rubus occidentalis) extract against hypercholesterolemia and hepatic inflammation in rats fed high-fat and high-choline diets. Nutrients. 2020. 12(8). 2448. doi: 10.3390/nu12082448.
- Yang J.J., Shu X.О., Herrington D.М., Moore S.С., Meyer K.A., Ose J. et al. Circulating trimethylamine N-oxide in association with diet and cardiometabolic biomarkers: an international pooled analysis. Am. J. Clin. Nutr. 2021. 113(5). 1145-1156. doi: 10.1093/ajcn/nqaa430.