Международный эндокринологический журнал Том 18, №6, 2022
Вернуться к номеру
Вміст вітаміну D у вагітних і його вплив на перебіг і завершення вагітності
Авторы: Бойчук А.В., Буднік Т.О.
Тернопільський національний медичний університет імені І.Я. Горбачевського МОЗ України,м. Тернопіль, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
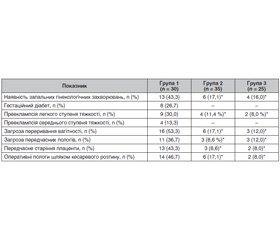
Актуальність. Дефіцит вітаміну D визнано глобальною проблемою охорони здоров’я, адже він стосується приблизно одного мільярда людей різного віку в усьому світі. Хоча дефіцит вітаміну D під час вагітності залишається важливою проблемою, в Україні проведено недостатньо досліджень, які підтверджують взаємозв’язок між рівнями вітаміну D і несприятливими наслідками вагітності. У той же час необхідно підкреслити важливість скринінгу рівня вітаміну D як одного з рутинних тестів на ранніх термінах вагітності, що сприятиме профілактиці порушень упродовж вагітності. Метою даного дослідження є визначення вмісту вітаміну D у вагітних і встановлення його впливу на перебіг і завершення вагітності. Матеріали та методи. Під спостереженням перебували 90 вагітних, відібраних за критеріями включення: термін вагітності понад 28 тижнів, відсутність прийому препаратів вітаміну D під час вагітності. Залежно від рівня 25(ОН)D у крові вагітні були розподілені на три групи. У першу групу увійшли 30 вагітних з дефіцитом вітаміну D у крові, що відповідає рівню 25(ОН)D менше за 20 нг/мл, у другу групу — 35 вагітних з недостатністю вітаміну D у крові, що відповідає рівню 25(ОН)D від 20 до 29,9 нг/мл. Жінки з нормальними показниками 25(ОН)D (> 30 нг/мл) сформували третю групу дослідження (n = 25). Результати. Серед екстрагенітальної патології захворювання шлунково-кишкового тракту майже втричі частіше відзначалися у вагітних з дефіцитом вітаміну D, ніж з його недостатністю, і виявилися значущим чинником розвитку дефіциту вітаміну D (співвідношення шансів (OR) 3,02; 95% довірчий інтервал (ДІ): 1,16–10,4; р < 0,05). Встановлено, що у вагітних першої групи дефіцит вітаміну D є фактором ризику захворювань опорно-рухового апарату (OR 4,38; 95% ДІ: 1,11–25,8; р < 0,05). Шляхом проведення глюкозотолерантного тесту (в термін вагітності 26–28 тижнів) діагноз гестаційного діабету був встановлений у восьми жінок першої групи (26,7 %). При цьому гестаційний діабет діагностовано на тлі ожиріння І–II ступеня. Дефіцит вітаміну D у матері вірогідно пов’язаний з високим ризиком кесаревого розтину й наявністю ускладнень під час вагітності й пологів. Висновки. Проведене дослідження свідчить про негативний вплив низьких рівнів 25(ОН)D на перебіг і наслідки вагітності.
Background. Vitamin D deficiency is recognized as a global health problem, affecting approximately one billion people of all ages worldwide. Although maternal vitamin D deficiency is a significant health concern, there are not enough studies in Ukraine that confirm the relationship between vitamin D levels and adverse pregnancy outcomes. At the same time, it is necessary to emphasize the importance of screening the level of vitamin D as one of the routine tests in the early stages of pregnancy, which will contribute to the prevention of disorders during pregnancy. The purpose of this study is to determine the content of vitamin D in pregnant women and establish its effect on pregnancy and maternal outcomes. Materials and methods. Ninety pregnant women were under observation, they were selected according to the inclusion criteria: pregnancy period over 28 weeks, no vitamin D intake during pregnancy. Depending on 25(OH)D serum level, pregnant women were divided into three groups. The first group included 30 patients with vitamin D deficiency of 25(OH)D level less than 20 ng/ml, the second group included 35 pregnant women with vitamin D insufficiency, 25(OH)D level of 20–29.9 ng/ml. Women with normal 25(OH)D levels (> 30 ng/ml) formed the third research group (n = 25). Results. Among extragenital pathologies, diseases of the gastrointestinal tract were observed almost three times more often with vitamin D deficiency than with its insufficiency, and turned out to be a significant factor for the development of vitamin D deficiency (odds ratio 3.02; 95 % confidence interval: 1.16–10.4; p < 0.05). It was found that in pregnant women of the first group, vitamin D deficiency is a risk factor for diseases of the musculoskeletal system (odds ratio 4.38; 95 % confidence interval: 1.11–25.8; p < 0.05). Eight women (26.7 %) from the first group were diagnosed with gestational diabetes by conducting a glucose tolerance test (at 26–28 weeks of pregnancy). At the same time, gestational diabetes was diagnosed against the background of obesity class I–II. Maternal vitamin D deficiency is reliably associated with a high risk of cesarean section and the presence of complications during pregnancy and childbirth. Conclusions. The conducted study shows the negative impact of low levels of 25(ОН)D on the course and consequences of pregnancy.
вагітність; дефіцит вітаміну D; недостатність вітаміну D
pregnancy; vitamin D deficiency; vitamin D insufficiency
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Amrein K., Scherkl M., Hoffmann M., Neuwersch-Sommeregger S., Köstenberger M., Tmava Berisha A., Martucci G., Pilz S., Malle O. Vitamin D deficiency 2.0: an update on the current status worldwide. Eur. J. Clin. Nutr. 2020. 74(11). 1498-1513. doi: 10.1038/s41430-020-0558-y.
- Özdemir A.A., Ercan Gündemir Y., Küçük M., Yıldıran Sarıcı D., Elgörmüş Y., Çağ Y., Bilek G. Vitamin D Deficiency in Pregnant Women and Their Infants. J. Clin. Res Pediatr. Endocrinol. 2018. 10(1). 44-50. doi: 10.4274/jcrpe.4706.
- Abbasian M., Chaman R., Amiri M., Ajami M.E., Jafari-Koshki T., Rohani H., Taghavi-Shahri S.M., Sadeghi E., Raei M. Vitamin D Deficiency in Pregnant Women and Their Neonates. Glob. J. Health Sci. 2016. 8(9). 54008. doi: 10.5539/gjhs.v8n9p83. PMID: 27157170; PMCID: PMC5064090.
- Pérez-López F.R., Pilz S., Chedraui P. Vitamin D supplementation during pregnancy: an overview. Curr. Opin. Obstet. Gynecol. 2020. 32(5). 316-321. doi: 10.1097/GCO.0000000000000641. PMID: 32487800.
- Baki Yildirim S., Koşar Can Ö. An investigation of vitamin D deficiency in pregnant women and their infants in Giresun province located in the Black Sea region of Turkey. J. Obstet. Gynaecol. 2019. 39(4). 498-503. doi: 10.1080/01443615.2018.1539469.
- Christoph P., Challande P., Raio L., Surbek D. High prevalence of severe vitamin D deficiency during the first trimester in pregnant women in Switzerland and its potential contributions to adverse outcomes in the pregnancy. Swiss Med. Wkly. 2020. 150. w20238. doi: 10.4414/smw.2020.20238. PMID: 32502277.
- Bouillon R., Manousaki D., Rosen C., Trajanoska K., Rivadeneira F., Richards J.B. The health effects of vitamin D supplementation: evidence from human studies. Nat. Rev. Endocrinol. 2022. 18(2). 96-110. doi: 10.1038/s41574-021-00593-z.
- Kaminskyi O.V., Pankiv V.I., Pankiv I.V., Afanasyev D.E. Vitamin D content in population of radiologically contaminated areas in Chernivtsi oblast (pilot project). Probl. Radiac. Med. Radiobiol. 2018. 23. 442-451. doi: 10.33145/2304-8336-2018-23-442-451. PMID: 30582861.
- Лоя Н.О., Корчинська О.О., Герзанич С.О., Гецко Н.В. Особливості перебігу вагітності та пологів у жінок із дефіцитом вітаміну D. Запорізький медичний журнал. 2020. 22(4). 440-445. Doi: 10.14739/2409-2932.2020.2.208347.
- Паєнок О., Маслягко В., Пеньків І. Вплив вітаміну D на перебіг вагітності, розвиток плода та здоров’я дітей у постнатальному періоді. Міжнародний ендокринологічний журнал. 2018. 14(7). 694-704. https://doi.org/10.22141/2224-0721.14.7.2018.148778.
- Татарчук Т.Ф., Булавенко О.В., Капшук І.М., Тарнопольська В.О. Недостатність вітаміну D у генезі порушень репродуктивного здоров’я. Український медичний часопис. 2015. 109. 56-60.
- Boychuk A.V., Budnik T.O. Vitamin D deficiency and pregnancy. Current issues of pediatrics, obstetrics and gynecology. 2016. 2. https://doi.org/10.11603/24116-4944.2016.2.6852.
- Davies-Tuck M., Yim C., Knight M., Hodges R., Doery J.C., Wallace E. Vitamin D testing in pregnancy: Does one size fit all? Aust. N. Z. J. Obstet. Gynaecol. 2015. 55(2). 149-55. doi: 10.1111/ajo.12278.
- Bialy L., Fenton T., Shulhan-Kilroy J., Johnson D.W., McNeil D.A., Hartling L. Vitamin D supplementation to improve pregnancy and perinatal outcomes: an overview of 42 systematic reviews. BMJ Open. 2020. 10(1). e032626. doi: 10.1136/bmjopen-2019-032626. PMID: 31964667; PMCID: PMC7044866.
- Karamali M., Asemi Z., Ahmadi-Dastjerdi M., Esmaillzadeh A. Calcium plus vitamin D supplementation affects pregnancy outcomes in gestational diabetes: randomized, double-blind, placebo-controlled trial. Public Health Nutr. 2016. 19(1). 156-63. doi: 10.1017/S1368980015000609.
- Bischoff-Ferrari H.A. Optimal serum 25-hydroxyvitamin D levels for multiple health outcomes. Adv. Exp. Med. Biol. 2014. 810. 500-25. doi: 10.1007/978-1-4939-0437-2_28. PMID: 25207384.
- Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., Gordon C.M., Hanley D.A., Heaney R.P., Murad M.H., Weaver C.M. Guidelines for preventing and treating vitamin D deficiency and insufficiency revisited. J. Clin. Endocrinol. Metab. 2012. 97(4). 1153-8. doi: 10.1210/jc.2011-2601.
- Pludowski P., Takacs I., Boyanov M., Belaya Z., Diaconu C.C., Mokhort T., Zherdova N., et al. Clinical Practice in the Prevention, Diagnosis and Treatment of Vitamin D Deficiency: A Central and Eastern European Expert Consensus Statement. Nutrients. 2022. 14(7). 1483. doi: 10.3390/nu14071483. PMID: 35406098; PMCID: PMC9002638.
- Gallo S., McDermid J.M., Al-Nimr R.I., Hakeem R., Moreschi J.M., Pari-Keener M., Stahnke B., Papoutsakis C., Handu D., Cheng F.W. Vitamin D Supplementation during Pregnancy: An Evidence Analysis Center Systematic Review and Meta-Analysis. J. Acad. Nutr. Diet. 2020. 120(5). 898-924.e4. doi: 10.1016/j.jand.2019.07.002.
- Weernink M.G., van Wijk R.M., Groothuis-Oudshoorn C.G., Lanting C.I., Grant C.C., van Vlimmeren L.A., Boere-Boonekamp M.M. Insufficient vitamin D supplement use during pregnancy and early childhood: a risk factor for positional skull deformation. Matern. Child Nutr. 2016. 12(1). 177-88. doi: 10.1111/mcn.12153.
- Karras S., Paschou S.A., Kandaraki E., Anagnostis P., Annweiler C., Tarlatzis B.C., Hollis B.W., Grant W.B., Goulis D.G. Hypovitaminosis D in pregnancy in the Mediterranean region: a systematic review. Eur. J. Clin. Nutr. 2016. 70(9). 979-86. doi: 10.1038/ejcn.2016.12.
- Тернопільський енциклопедичний словник: у 4 т. / редкол.: Яворський Г. та ін. Тернопіль: Збруч, 2004–2010. ISBN 966-528-197-6.
- De-Regil L.M., Palacios C., Lombardo L.K., Peña-Rosas J.P. Vitamin D supplementation for women during pregnancy. Cochrane Database Syst. Rev. 2012. (2). CD008873. doi: 10.1002/14651858.CD008873.pub2.
- NDA; EFSA. Dietary reference values for vitamin D. EFSA J. 2016. 14. e04547. doi: 10.2903/j.efsa.2016.4547.
- Ross A.C., Taylor C.L., Yaktine A.L., Del Valle H.B., editors. Dietary Reference Intakes for Calcium and Vitamin D. Washington (DC): National Academies Press (US), 2011.
- Munns C.F., Shaw N., Kiely M. et al. Global Consensus Recommendations on Prevention and Management of Nutritional Rickets. J. Clin. Endocrinol. Metab. 2016. 101(2). 394-415. doi: 10.1210/jc.2015-2175.
- Dawodu A., Saadi H.F., Bekdache G., Javed Y., Altaye M., Hollis B.W. Randomized controlled trial (RCT) of vitamin D supplementation in pregnancy in a population with endemic vitamin D deficiency. J. Clin. Endocrinol. Metab. 2013. 98(6). 2337-46. doi: 10.1210/jc.2013-1154.
- Hollis B.W., Johnson D., Hulsey T.C., Ebeling M., Wagner C.L. Vitamin D supplementation during pregnancy: double-blind, randomized clinical trial of safety and effectiveness. J. Bone Miner. Res. 2011. 26(10). 2341-57. doi: 10.1002/jbmr.463.

/14.jpg)
/15.jpg)