Международный эндокринологический журнал Том 18, №6, 2022
Вернуться к номеру
Патофізіологічні основи саркопенії — хронічного ускладнення цукрового діабету
Авторы: Ковальчук А.В., Зінич О.В., Кушнарьова Н.М., Прибила О.В., Шишкань-Шишова К.О.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
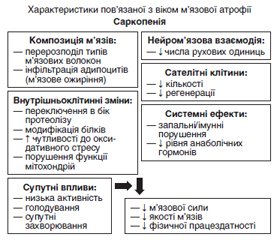
Огляд присвячений проблемі саркопенії — м’язової слабкості та втрати маси, якості та сили скелетних м’язів, що часто супроводжує захворювання на цукровий діабет 2-го типу, особливо в осіб похилого віку. Останнім часом саркопенію розглядають як одне з ускладнень цукрового діабету, яке асоціюється зі збільшенням частоти серцево-судинних ускладнень, необхідності госпіталізації та смертності пацієнтів. Молекулярні механізми атрофії м’язів при саркопенії пов’язані з порушенням анаболічно-катаболічної рівноваги в м’язах та їх енергетичного забезпечення, жировою інфільтрацією та зрушеннями протеостазу (зниженням синтезу м’язових білків та посиленням їх деградації), мітохондріальною дисфункцією. У патогенезі як саркопенії, так і дисметаболічних ускладнень при цукровому діабеті ключову роль відіграють інсулінорезистентність, оксидативний стрес, накопичення абдомінального та ектопічного жиру, локальне запалення, тобто відзначається двонаправлений зв’язок між цими патологічними станами, які взаємно підсилюють негативні наслідки один одного. За даними клінічних спостережень, ризик саркопенії в пацієнтів з цукровим діабетом у 3–4 рази вищий, ніж в осіб без діабету, при цьому наявність саркопенії підвищує ризик зниження працездатності, інвалідизації, смертності, погіршення контролю цукрового діабету. Ці дані вказують на доцільність проведення скринінгу щодо ознак саркопенії у пацієнтів з цукровим діабетом 2-го типу, особливо старшої вікової групи, з використанням динамічних тестів, а також моніторингу стану кісткової тканини, щоб запобігти ризику падінь і переломів. Цукрознижувальна терапія для таких пацієнтів повинна включати засоби, що сприяють збереженню м’язової та кісткової тканини (мають анаболічну дію), не збільшують ризик гіпоглікемії та шлунково-кишкових розладів. Згідно з даними літератури, до найбільш безпечних засобів належать бігуанід метформін, інгібітори дипептидилпептидази та інсулін. Не рекомендовані похідні сульфонілсечовини, тіазолідиндіони, агоністи ГПП-1, інгібітори SGLT-2, які можуть чинити небажані для ослаблених літніх людей ефекти. Своєчасна діагностика саркопенії є важливою для запобігання погіршенню м’язової функції (шляхом реабілітації опорно-рухового апарату за допомогою адаптивних фізичних вправ та модифікації дієти) та підвищення якості життя хворих на цукровий діабет 2-го типу. У свою чергу, удосконалення профілактики та лікування цукрового діабету на ранніх стадіях також може допомогти запобігти розвитку саркопенії та її ускладнень.
The review considers the problem of sarcopenia, a muscle weakness and loss of mass, quality and strength of skeletal muscles, which often accompanies type 2 diabetes, especially in the elderly. Recently, sarcopenia has been considered as one of the complications of diabetes, which is associated with an increase in the frequency of cardiovascular complications, the need for hospitalization, and patient mortality. The molecular mechanisms of muscle atrophy in sarcopenia are associated with a violation of the anabolic-catabolic balance in muscles and their energy supply, fatty infiltration and shifts in proteostasis (decreasing the synthesis of muscle proteins and increasing their degradation), mitochondrial dysfunction. Insulin resistance, oxidative stress, accumulation of abdominal and ectopic fat, local inflammation play a key role in the pathogenesis of both sarcopenia and dysmetabolic diabetic complications, i.e., there is a bidirectional relationship between these pathological conditions, which mutually reinforce each other’s negative consequences. According to clinical observations, the risk of sarcopenia in patients with diabetes is 3–4 times higher than in people without diabetes, while the presence of sarcopenia increases the risk of reduced work capacity, disability, mortality, and worsening of diabetes control. These data indicate the feasibility of screening for signs of sarcopenia in patients with type 2 diabetes, especially in the older age group, using dynamic tests, as well as bone monitoring, to prevent the risk of falls and fractures. Antidiabetic therapy for such patients should include drugs that help preserve muscle and bone tissue (have an anabolic effect), do not increase the risk of hypoglycemia and gastrointestinal disorders. According to the literature, the safest preparations include the biguanide metformin, dipeptidyl peptidase inhibitors, and insulin. Sulfonylurea derivatives, thiazolidinediones, glucagon-like peptide-1 receptor agonists, sodium-glucose cotransporter-2 inhibitors are not recommended, as they can cause undesirable effects in weakened elderly people. Timely diagnosis of sarcopenia is important to prevent the deterioration of muscle function (through the rehabilitation of the musculoskeletal system using adaptive physical exercises and diet modification) and to improve the quality of life of patients with type 2 diabetes. In turn, improving the prevention and treatment of diabetes in the early stages can also help prevent the development of sarcopenia and its complications.
саркопенія; цукровий діабет; інсулінорезистентність; цукрознижувальна терапія; огляд
sarcopenia; diabetes; insulin resistance; hypoglycemic therapy; review
Саркопенія як геріатричний синдром
/41.jpg)
Саркопенія як ускладнення цукрового діабету
Саркопенія та кісткова система
Цукрознижувальні препарати і саркопенія
Висновки
- Wiedmer P., Jung T., Castro J., Pomatto L., Sun P., Davies K., et al. Sarcopenia — Molecular mechanisms and open questions. Ageing Research Reviews. 2021. 65 (1). 101200. https://doi.org/10.1016/j.arr.2020.101200
- Tong Q., Wang X., Sheng Y., Chen S., Lai B., Lv R., Yu J. Metabolic syndrome and its association with components of sarcopenia in older community-dwelling Chinese. J. Biomed. Res. 2022. 36(2). 120-126. doi: 10.7555/JBR.36.20210143.
- Argilés J.M., Campos N., Lopez-Pedrosa J.M., Rueda R., Rodriguez-Mañas L. Skeletal Muscle Regulates Metabolism via Interorgan Crosstalk: Roles in Health and Disease. J. Am. Med. Dir. Assoc. 2016. 17(9). 789-96. doi: 10.1016/j.jamda.2016.04.019.
- Hamasaki H., Kawashima Y., Katsuyama H., Sako A., Goto A., Yanai H. Association of handgrip strength with hospitalization, cardiovascular events, and mortality in Japanese patients with type 2 diabetes. Sci. Rep. 2017. 7. 1-9. https://doi.org/10.1038/s41598-017-07438-8.
- Liccini A., Malmstrom T. Frailty and sarcopenia as predictors of adverse health outcomes in persons with diabetes mellitus. J. Am. Med. Dir. Assoc. 2016. 17. 846-851. doi: 10.1016/j.jamda.2016.07.007.
- Takahashi F., Hashimoto Y., Kaji A., Sakai R., Okamura T., Kitagawa N., et al. Sarcopenia is associated with a risk of mortality in people with type 2 diabetes mellitus. Front. Endocrinol. (Lausanne). 2021. 12. 783363. doi: 10.3389/fendo.2021.783363.
- Trierweiler H., Kisielewicz G., Hoffmann Jonasson T., Petterle R, Moreira C., Borba V. Sarcopenia: a chronic complication of type 2 diabetes mellitus. Diabetol. Metab. Syndr. 2018. 10(25). 1-9. https://doi.org/10.1186/s13098-018-0326-5.
- Billot M., Calvani R., Urtamo A., Sánchez-Sánchez J., Ciccolari-Micaldi C., Chang M., et al. Preserving mobility in older adults with physical frailty and sarcopenia: opportunities, challenges, and recommendations for physical activity interventions. Clin. Interv. Aging. 2020. 15. 1675-1690. doi: 10.2147/cia.S253535.
- Cruz-Jentoft A.J., Baeyens J.P., Bauer J..M, Boirie Y., Cederholm T., Landi F., Martin F.C., Michel J.P., Rolland Y., Schneider S.M., Topinková E., Vandewoude M., Zamboni M. Sarcopenia: European consensus on definition and diagnosis. Age Ageing. 2010. 39. 412-23. https://doi.org/10.1093/ageing/afq034.
- Rosenberg I. Summary comments: epidemiological and methodological problems in determining nutritional status of older persons. Am. J. Clin. Nutr. 1989. 50 (5). 1231-1233.
- Chung S.M., Moon J.S., Chang M.C. Prevalence of sarcopenia and its association with diabetes: a meta-analysis of community-dwelling asian population. Front. Med. 2021. 8. 681232. https://doi.org/10.3389/fmed.2021.681232.
- Filippin L.I., de Oliveira T., da Silva M., Miraglia F., da Silva F.S. Sarcopenia: a predictor of mortality and the need for early diagnosis and intervention. Aging Clin. Exp. Res. 2015. 27. 249-54. https://doi.org/10.1007/s40520-014-0281-4.
- Morley J.E., Malmstrom T.K., Rodriguez-Mañas L., Sinclair A.J. Frailty, sarcopenia and diabetes. J. Am. Med. Dir. Assoc. 2014. 15 (12). 853-9. https://doi.org/10.1016/j.jamda.2014.10.001.
- Park J.-W., Kim H.-S., Lee Y.-K., Yoo J.-I., Choi Y., et al. Sarcopenia: an unsolved problem after hip fracture. J. Bone Miner. Metab. 2022 Jul. 40(4). 688-695. doi: 10.1007/s00774-022-01334-6.
- Cruz-Jentoft A.J., Bahat G., Bauer J., Boirie Y., Bruyère O., Cederholm T., et al.; Writing Group for the European Working Group on Sarcopenia in Older People 2 (EWGSOP2), and the Extended Group for EWGSOP2. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing. 2019. 48(1). 16-31. doi: 10.1093/ageing/afy169.
- Chen L.K., Woo J., Assantachai P., Auyeung T.W., Chou M.Y., Iijima K., et al. Asian Working Group for Sarcopenia: 2019 consensus update on sarcopenia diagnosis and treatment. J. Am. Med. Dir. Assoc. 2020. 21(3). 300-307.e2. doi: 10.1016/j.jamda.2019.12.012.
- Scheerman K., Meskers C., Verlaan S., Maier A. Sarcopenia, low handgrip strength, and low absolute muscle mass predict long-term mortality in older hospitalized patients: an observational inception cohort study. J. Am. Med. Dir. Assoc. 2021. 22 (4). 816-820.e2. doi: 10.1016/j.jamda.2020.12.016.
- Lee M..M, Jebb S.A., Oke J., Piernas C. Reference values for skeletal muscle mass and fat mass measured by bioelectrical impedance in 390 565 UK adults. J. Cachexia Sarcopenia Muscle. 2020. 11(2). 487-496. doi: 10.1002/jcsm.12523.
- Costanzo L., De Vincentis A., Di Iorio A., Bandinelli S., Ferrucci L., Antonelli Incalzi R., Pedone C. Impact of low muscle mass and low muscle strength according to EWGSOP2 and EWGSOP1 in community-dwelling older people. J. Gerontol. Biol. Sci. Med. Sci. 2020. 75(7). 1324-1330. doi: 10.1093/gerona/glaa063.
- Buckinx F., Landi F., Cesari M., Fielding R.A., Visser M., Engelke K. et al. Pitfalls in the measurement of muscle mass: a need for a reference standard. J. Cachexia Sarcopenia Muscle. 2018. 9 (2). 269-278. doi: 10.1002/jcsm.12268.
- Bahat G., Yilmaz O., Kılıç C., Oren M.M., Karan M.A. Performance of SARC-F in regard to sarcopenia definitions, muscle mass and functional measures. J. Nutr. Health Aging. 2018. 22 (8). 898-903. doi: 10.1007/s12603-018-1067-8.
- Ishii S., Tanaka T., Shibasaki K., Ouchi Y., Kikutani T., Higashiguchi T., et al. Development of a simple screening test for sarcopenia in older adults. Geriatr. Gerontol. Int. 2014. 14 (Suppl. 1). 93-101. doi: 10.1111/ggi.12197.
- Sbrignadello S., Göbl C., Tura A. Bioelectrical Impedance Analysis for the Assessment of Body Composition in Sarcopenia and Type 2 Diabetes. Nutrients. 2022. 14 (9). 1864. doi: 10.3390/nu14091864.
- Cho M.R., Lee S., Song S.K. A Review of sarcopenia pathophysiology, diagnosis, treatment and future direction. J. Korean Med. Sci. 2022. 37 (18). e146. doi: 10.3346/jkms.2022.37.e146.
- Giha H., Alamin O., Sater M. Diabetic sarcopenia: metabolic and molecular appraisal Acta Diabetol. 2022. 59 (8). 989-1000. doi: 10.1007/s00592-022-01883-2.
- Sakuma K., Aoi W., Yamaguchi A. The intriguing regulators of muscle mass in sarcopenia and muscular dystrophy. Front Aging Neurosci. 2014. 6. 230. doi: 10.3389/fnagi.2014.00230.
- Verdijk L.B., Snijders T., Drost M., Delhaas T., Kadi F., van Loon L.J. Satellite cells in human skeletal muscle; from birth to old age. Age (Dordr). 2014. 36 (2). 545-547. doi: 10.1007/s11357-013-9583-2.
- Rodrigues F., Domingos C., Monteiro D., Morouço P. A Review on Aging, Sarcopenia, Falls, and Resistance Training in Community-Dwelling Older Adults. Int. J. Environ. Res. Public Health. 2022. 19(2). 874. doi: 10.3390/ijerph19020874.
- Mesinovic J., Zengin A., De Courten B., Ebeling P., Scott D. Sarcopenia and type 2 diabetes mellitus: a bidirectional relationship. Diabetes Metab. Syndr. Obes. 2019. 12. 1057-1072. doi: 10.2147/DMSO.S186600.
- Scott D., Seibel M., Cumming R., Naganathan V., Blyth F., Le Couteur D.G., Handelsman D.J., Waite L.M., Hirani V. Sarcopenic obesity and its temporal associations with changes in bone mineral density, incident falls, and fractures in older men: the concord health and ageing in men project. J. Bone Miner. Res. 2017. 32. 575-83. https://doi.org/10.1002/jbmr.3016.
- An K.O., Kim J. Association of sarcopenia and obesity with multimorbidity in Korean adults: a Nationwide Cross-Sectional Study. J. Am. Med. Dir. Assoc. 2016. 17. 960. e1-960.e7. https://doi.org/10.1016/j.jamda.2016.07.005.
- Feng L., Gao Q., Hu K., Wu M., Wang Z., Chen F., et al. Prevalence and Risk Factors of Sarcopenia in Patients With Diabetes: A Meta-analysis. J. Clin. Endocr. Metab. 2022. 107(Issue 5). 1470-1483. https://doi.org/10.1210/clinem/dgab884.
- Wong E., Backholer K., Gearon E., Harding J., Freak-Poli R., Stevenson C., Peeters A. Diabetes and risk of physical disability in adults: a systematic review and meta-analysis. Lancet Diabetes Endocrinol. 2013. 1(2). 106-14. doi: 10.1016/S2213-8587(13) 70046-9.
- Beretta M., Filho F., Freiberg R., Feldman J., Nery C., Rodrigues T. Sarcopenia and Type 2 diabetes mellitus as predictors of 2-year mortality after hospital discharge in a cohort of hospitalized older adults. Diabetes Res. Clin. Pract. 2020. 159. 107969. doi: 10.1016/j.diabres.2019.107969.
- Koo B.K., Moon S., Moon M.K. Muscle strength, an independent determinant of glycemic control in older adults with long-standing type 2 diabetes: a prospective cohort study. BMC Geriatr. 2021. 21(1). 684. doi: 10.1186/s12877-021-02629-5.
- Landi F., Onder G., Bernabei R. Sarcopenia and diabetes: two sides of the same coin. J. Am. Med. Dir. Assoc. 2013. 14 (8). 540-1. https://doi.org/10.1016/j.jamda.2013.05.004.
- Sanz-Cánovas J., López-Sampalo A., Cobos-Palacios L., Ricci M., Hernández-Negrín H., Mancebo-Sevilla J. Management of type 2 diabetes mellitus in elderly patients with frailty and/or sarcopenia. Int. J. Environ. Res. Public Health. 2022. 19. 8677. https://doi.org/10.3390/ijerph19148677.
- Massimino E., Izzo A., Riccardi G., Della Pepa G. The Impact of Glucose-Lowering Drugs on Sarcopenia in Type 2 Diabetes: Current Evidence and Underlying Mechanisms. Cells. 2021. 10(8). 1958. doi: 10.3390/cells10081958.
- Piskovatska V., Stefanyshyn N., Storey K.B., Vaiserman A.M., Lushchak O. Metformin as a geroprotector: experimental and clinical evidence. Biogerontology. 2019. 20(1). 33-48. doi: 10.1007/s10522-018-9773-5.
- Fanzani A., Conraads V.M., Penna F., Martinet W. Molecular and cellular mechanisms of skeletal muscle atrophy: an update. J. Cachexia Sarcopenia Muscle. 2012. 3(3). 163-79. doi: 10.1007/s13539-012-0074-6.
- Sugimoto K., Ikegami H., Takata Y., Katsuya T., Fukuda M., Akasaka H., Tabara Y., et al. Glycemic Control and Insulin Improve Muscle Mass and Gait Speed in Type 2 Diabetes: The MUSCLES-DM Study. J. Am. Med. Dir. Assoc. 2021. 22(4). 834-838.e1. doi: 10.1016/j.jamda.2020.11.003.
- Goncharova O. Sarcopenia in type 2 diabetes mellitus (review and own observations). International Journal of Endocrinology (Ukraine). 2017. 13(2). 186-194. https://doi.org/10.22141/2224-0721.13.2.2017.100611.

/42.jpg)