Перелік скорочень: ГПТ — гіперпаратиреоз; ВГПТ — вторинний ГПТ; МЩКТ — мінеральна щільність кісткової тканини; нк-ПГПТ — нормокальціємічний первинний ГПТ; ПЩПЗ — прищитоподібні залози; ПГПТ — первинний ГПТ; ПТГ — паратгормон; УЗД — ультразвукове дослідження; ЩПЗ — щитоподібна залоза.
Гіперпаратиреоз (ГПТ) — клінічний стан, при якому виявляється збільшення концентрації паратгормону (ПТГ) в сироватці крові. Паратгормон виробляється прищитоподібними залозами (ПЩПЗ), які є головними регуляторами обміну кальцію та фосфору. Зазвичай чотири ПЩПЗ розташовані позаду щитоподібної залози (ЩПЗ). Їх може бути більше (до 14) або менше чотирьох, деякі можуть розташовуватись атипово, далеко від ЩПЗ. Усі фізіологічні процеси, у яких використовуються іони кальцію та фосфору (клітинні насоси, передача електричних імпульсів, скорочення м’язів, структура скелета), регулюються ПЩПЗ. Їх діяльність у взаємозв’язку з вітаміном D впливає на артеріальний тиск, ритм серця, настрій, стан нервової, серцево-судинної, статевої, кісток, суглобів, ренальної та інших систем. ПТГ є ключовим регулятором метаболізму кальцію, він стимулює резорбцію (руйнування, розсмоктування, деградацію) кісткової тканини, підвищує рівень кальцію та фосфору в сироватці крові та сприяє синтезу вітаміну D (компенсаторний механізм).
Стан ПЩПЗ дуже сильно залежить від кількості вітаміну D, магнію та бору в крові. Так, за офіційними даними, обґрунтованими низкою наукових досліджень, більшість населення (80 %) планети має нестачу/дефіцит вітаміну D, що пояснює значну поширеність захворювань ПЩПЗ (гіперплазії, аденоми, гіперпаратиреози) та асоційованої з нею патології. За попередніми дослідженнями, в Україні спостерігається дефіцит/нестача вітаміну D у 85–94 % населення.
У нормальних фізіологічних умовах основним регулятором секреції ПТГ і функції ПЩПЗ є кальційчутливий рецептор (CaSR) [1]. Активація CaSR сироватковим кальцієм швидко пригнічує синтез і секрецію ПТГ та ріст ПЩПЗ. Крім того, CaSR впливає на експресію гена ПТГ і може також посилювати регуляцію рецептора вітаміну D (VDR) [1]. ПЩПЗ експресують високі рівні VDR, що при активації зв’язуванням вітаміну D зменшує транскрипцію гена ПТГ; навпаки, зниження рівня вітаміну D або його дефіцит компенсаторно стимулюють синтез ПТГ [1]. Активація VDR у шлунково-кишковому тракті збільшує всмоктування кальцію, таким чином підвищуючи рівень кальцію в сироватці крові та контролюючи діяльність ПЩПЗ через активацію CaSR. Постійна стимуляція ПЩПЗ порушеннями мінерального гомеостазу сприяє синтезу ПТГ і, зрештою, призводить до гіперплазії ПЩПЗ [1]. Через їх невід’ємну роль у патогенезі вторинного ГПТ (ВГПТ) CaSR, VDR і FGF-23 є ймовірними біологічними мішенями для нових методів лікування цих розладів.
Сьогодні в медичній та науковій літературі можна прочитати, що первинний гіперпаратиреоз (ПГПТ) є поширеною клінічною проблемою, для якої єдиним остаточним лікуванням є хірургічне втручання [2].
Дійсно класичні варіанти ПГПТ та третинного ГПТ (ТГПТ) зі значним підвищенням концентрації кальцію та зниженням фосфору в сироватці крові є загрозливими станами, часто потребують хірургічного втручання, але не завжди. Також існують такі варіанти гіперпаратиреозів, як асимптоматичний, нормокальціємічний ГПТ (нк-ГПТ), вторинний ГПТ, внаслідок нестачі/дефіциту вітаміну D або інших чинників, які здебільшого можуть ефективно лікуватися без хірургічних втручань. Діагностичні критерії гіперпаратиреоїдних станів дуже розмиті, що вводить в оману та призводить до проведення непотрібних операцій замість простої терапії препаратами вітаміну D та бору. Іноді здається, що існує зацікавленість хірургів щодо нерозуміння цих питань ендокринологами та терапевтами, що стимулює зайву хірургічну активність. Нашою метою було розібратися в цих питаннях.
Майже всі існуючі рекомендації та настанови лікування ГПТ були створені хірургами, затверджуються на конгресах хірургічного профілю, часто без участі фахівців-ендокринологів. Помилковою думкою хірургів є те, що всі захворювання можна вилікувати завдяки оперативним втручанням, на відміну від терапевтів-ендокринологів, які використовують для цього пігулки. Видалення однієї ПЩПЗ із декількох через певний час призводить до значного збільшення іншої. Переважна більшість хронічних захворювань не розпочинається гостро, їм потрібен великий час (роки, десятиліття) до того, поки патологічний процес дійде до своєї критичної точки, коли вже тільки оперативне втручання може врятувати пацієнта. Це справедливо для всіх ГПТ, навіть для ПГПТ. Своєчасне виявлення змінених ПЩПЗ (аденоми) та їх збільшення (гіперплазії) завдяки застосуванню ультразвукового дослідження (УЗД) навченими фахівцями і визначення рівня ПТГ у сироватці крові дозволяють своєчасно почати їх лікування без подальших оперативних втручань.
Профілактичне застосування вітаміну D у правильних індивідуалізованих дозах повинно було б зменшити ймовірність розвитку патології ПЩПЗ, однак таку терапію отримують лише 10 % населення, інші не знають про її користь. Більшість спеціалістів УЗД не мають навичок виявлення ПЩПЗ, просто їх не бачать, навіть за наявності великих і множинних аденом, хоча ми раніше публікували методологію УЗД ПЩПЗ [3, 4].
Також лікарі дуже рідко визначають рівень ПТГ, що пролонгує прогресування ГПТ, а виявляють його, лише коли вже відмічаються глибокі асоційовані зміни інших систем (аритмії, сечокам’яна і жовчнокам’яна хвороби, виразкова хвороба шлунка, остеопороз, остеопенія та інші), приєднується збільшення рівня іонізованого кальцію, що вже майже гарантовано потребує хірургічного лікування не лише ПЩПЗ, але і нирок, і жовчного міхура.
ГПТ виникає, коли одна або кілька ПЩПЗ стають гіперактивними, що поступово призводить до підвищення рівня ПТГ у сироватці та гіперкальціємії. Такі пацієнти можуть бути безсимптомними або мати симптоми різного ступеня тяжкості, включаючи хронічну втому, біль у тілі, порушення сну, біль у кістках, втрату пам’яті, погану концентрацію, депресію та головний біль [5]. Діагноз ґрунтується на вимірюванні рівня ПТГ та кальцію (краще іонізованого) у сироватці крові. Причинами гіперпаратиреозу можуть бути аденоми ПЩПЗ, гіперплазія ПЩПЗ або інші причини (зниження швидкості клубочкової фільтрації і т.п.).
ПТГ підвищує рівень кальцію в сироватці шляхом посилення дистальної реабсорбції кальцію в нирках, швидкою мобілізацією кальцію і фосфатів із кісток (резорбція кісток), а також за рахунок збільшення всмоктування кальцію з кишечника завдяки стимуляції перетворення у нирках вітаміну D до найактивнішої форми — кальцитріолу (1,25(OH)2D3) [5].
Рівень ПТГ у крові допомагає диференціювати первинний ГПТ від інших причин гіперкальціємії. Найчастішою іншою причиною гіперкальціємії може бути наявність злоякісного новоутворення, при якому рівні ПТГ є характерно пригніченими [6]. Це відбувається тому, що очікуваною реакцією нормальних ПЩПЗ на гіперкальціємію є помітне пригнічення їх функції.
Важливою є можливість диференціювати пацієнтів із гіперкальціємією, в яких рівень кальцію в сироватці крові стає нормальним час від часу (нк-ГПТ), від тих осіб, в яких рівень кальцію в сироватці завжди нормальний (ВГПТ).
Британський стандарт (NICE, 2020) рекомендує використовувати вимірювання рівня загального кальцію в сироватці крові з поправкою на альбумін за формулою. Це слід повторити в закладах первинної медичної допомоги принаймні один раз, якщо перше вимірювання становило ≥ 2,6 ммоль/л або ≥ 2,5 ммоль/л і наявні ознаки ПГПТ [7]. Однак за кордоном вважається, що визначення іонізованого кальцію є більш дорогим і потребує додаткового обладнання. Тому ми рекомендуємо, як і американські фахівці, вивчати саме іонізований кальцій, бо це дає більш докладні дані і не потребує складного перерахування за формулою з альбуміном.
Первинний гіперпаратиреоз
ПГПТ є поширеним розладом, що виникає вна–слідок автономного надлишкового вироблення ПТГ однією або декількома аномальними ПЩПЗ, що призводить до стійкого підвищення концентрації кальцію в сироватці крові з відповідним збільшенням або невідповідно нормальним (тобто непригніченим) рівнем ПТГ [2].
Коли первинний ГПТ був вперше виявлений близько 100 років тому, він завжди був симптоматичним (класичним варіантом): із каменями в нирках (нефролітіазом), захворюваннями кісток і вираженою гіперкальціємією. З появою сучасних багатоканальних аналізаторів крові клінічний фенотип змінився на розлад, що характеризується легкою гіперкальціємією та відсутністю інших класичних ознак захворювання [6].
Рекомендації Американської асоціації ендокринних хірургів (2016 р.) показують, що для ПГПТ характерними рисами є гіперкальціємія, гіпофосфатемія та посилена резорбція кісткової тканини (що призводить до остеопенії/остеопорозу — зменшення мінеральної щільності кісткової тканини (МЩКТ)). Приблизно у 85 % випадків ПГПТ при гістологічному дослідженні тканини виявляється солітарна (одинична) аденома ПЩПЗ, хоча аденому іноді складно відрізнити від нормальної незміненої тканини. Інші 15 % випадків пов’язані з гіперплазією двох або більше ПЩПЗ [2]. Пацієнти із симптоматичним ПГПТ мають явні ознаки та симптоми (включаючи нервово-психічні, часто когнітивні, м’язово-скелетні та шлунково-кишкові скарги). Пацієнти з ПГПТ можуть мати вищий ризик інфаркту міокарда, гіпертензії, аритмії, інсульту, застійної серцевої недостатності, цукрового діабету та смертності.
Пацієнти з безсимптомним (асимптоматичним) ПГПТ не мають симптомів, характерних для захворювання. Пацієнти з безсимптомним ПГПТ можуть мати нефрокальциноз або тихий нефролітіаз; обидва є показаннями до паратиреоїдектомії [2]. Природна історія асимптоматичного ПГПТ показує, що у двох третин хворих перебіг залишається стабільним невизначено довго, тоді як до 15 років проспективного спостереження в однієї третини пацієнтів будуть виявлені ознаки прогресування (наприклад, камінці в нирках, погіршення гіперкальціємії, зниження МЩКТ) [8] (табл. 1).
Нормокальціємічний ПГПТ — клінічний феномен, при якому спостерігається підвищення рівнів ПТГ при нормальних значеннях кальцію в сироватці та за відсутності причин вторинного гіперпаратиреозу, таких як недостатність вітаміну D, захворювання нирок, мальабсорбція та ін. [9]. За наявності нестачі вітаміну D встановлюють вторинний ГПТ, у даному разі — нормокальціємічний ВГПТ.
Нормокальціємічний ПГПТ є нещодавно визнаним, не повністю охарактеризованим варіантом, який проявляється високими рівнями ПТГ, що виділяється однією або декількома ПЩПЗ, і нормальним рівнем загального та іонізованого кальцію в сироватці крові [2]. Деякі, але не всі пацієнти можуть мати прогресуючий перебіг, який із часом призводить до гіперкальціємічного ГПТ [5]. Пацієнти з нк-ПГПТ матимуть найбільш легку та найбільш безсимптомну форму захворювання. Нк-ПГПТ може бути раннім біо–хімічним проявом гіперкальціємічного ПГПТ, але де грань — не ясно.
За визначенням Європейського консенсусу із захворювань ПЩПЗ (2022 р.) нк-ПГПТ можна розглядати, якщо існують біохімічні ознаки стійкого (> 3 місяців) підвищеного рівня ПТГ на тлі незмінно нормального загального, який скориговано за альбуміном та/або вільного іонізованого рівня кальцію, на основі серійних лабораторних вимірювань, коли всі вторинні причини підвищення ПТГ були виключені [10]. Отже, нк-ПГПТ є діагнозом виключення, і його можна розглядати лише після ретельної оцінки причин вторинного гіперпаратиреозу, у тому числі пов’язаного з нестачею вітаміну D.
Лікування первинного гіперпаратиреозу
Хоча існує багато фармакологічних агентів, які застосовуються для зниження рівня кальцію в сироватці крові або для стабілізації МЩКТ, жоден не покращував обидва показники [2]. Якщо немає наміру поліпшити мінеральну щільність кісткової тканини або знизити концентрацію кальцію в сироватці крові, фармакологічні засоби не застосовують [7].
Тому паратиреоїдектомія є єдиним остаточним методом лікування ПГПТ. Очікується, що пацієнти із симптоматичним ПГПТ мають явну користь від видалення змінених ПЩПЗ, а пацієнти з безсимптомним ПГПТ часто повідомляють про покращення показників якості життя [2]. Американська асоціація ендокринних хірургів вказує, що спостереження та фармакологічна терапія є менш ефективними та менш рентабельними, ніж хірургічне втручання, навіть якщо пацієнт вважається безсимптомним. Слід уникати тривалої гіперкальціємії через можливі шкідливі наслідки. Рекомендується звернутися до кваліфікованого хірурга, який має досвід видалення ПЩПЗ, щоб визначити, чи ймовірність і переваги лікування переважають очікувані ризики процедури [2]. Після успішної паратиреоїдектомії розвиток нових камінців у нирках помітно зменшується. Хоча ниркова недостатність і нефрокальциноз не усуваються, хірургічне втручання може запобігти подальшому зниженню швидкості клубочкової фільтрації.
Хірургічне втручання рекомендовано, якщо порогове значення для сироваткового кальцію залишається на > 1 мг/дл (> 0,25 ммоль/л) вище від верхньої межі норми, а також особам віком 50 років і старше, які мають Т-показник МЩКТ –2,5 або менше, зниження кліренсу креатиніну до < 60 мл/хв [8].
Європейське товариство ендокринних хірургів пропонує вимірювати кальцій, магній, 25-гідроксивітамін D (25(OH)D) і ПТГ перед будь-якою операцією на передній частині шиї та лікувати дефіцит вітаміну D і магнію. Наступного дня після операції на ЩПЗ або ПЩПЗ слід виміряти рівні ПТГ та іонізованого кальцію, щоб виявити пацієнтів із ризиком розвитку гіпопаратиреозу [10]. Пацієнтам із дефіцитом вітаміну D перед операцією рекомендується розпочати прийом препаратів вітаміну D. Декілька досліджень підтвердили його безпеку, коли рівень кальцію становить < 3 ммоль/л (12 мг/дл).
Паратиреоїдектомія для ПГПТ не рекомендована, якщо ризики хірургічного втручання чи анестезії переважують очікувані переваги лікування, як, наприклад, у разі тяжкого або основного захворювання [2]. У пацієнтів, які не відповідають жодному показанню для хірургічного втручання, відмовляються від хірургічного втручання або мають надзвичайно високі ризики, застосовуються медичні втручання, спрямовані на пом’якшення конкретних наслідків. У багатьох пацієнтів хвороба легкого ступеня прогресує з часом. Для збільшення МЩКТ терапія бісфосфонатами була б вибором. Якщо існує занепокоєння щодо рівня концентрації кальцію в сироватці крові, цинакальцет є вибором для його зниження [8].
Усі пацієнти, за якими планується спостереження без хірургічного втручання, повинні отримувати достатню дозу вітаміну D. Вітамін D слід давати в помірних кількостях, щоб досягти мінімального рівня 25(OH)D у сироватці — > 20 нг/дл (50 нмоль/л) [8]. Як правило, при ПГПТ корисною початковою дозою є від 800 до 1000 МО. Оскільки є певні докази того, що рівні > 30 нг/мл можуть бути пов’язані з подальшим зниженням рівнів ПТГ, можна навести обґрунтований аргумент для досягнення цього вищого порогового значення [8]. Споживання кальцію має відповідати рекомендаціям, встановленим для всіх людей. Не рекомендується обмежувати споживання кальцію при ПГПТ [8]. DXA-сканування таким пацієнтам слід проводити кожні 2–3 роки [7]. Вагітні жінки з ПГПТ повинні перебувати під наглядом спеціалізованої міждисциплінарної команди, оскільки мають підвищений ризик артеріальної гіпертензії під час вагітності.
Рівень кальцію в сечі за 24 години важливий, щоб відрізнити ПГПТ від сімейної гіпокальційуричної гіперкальціємії, яка є автосомно-домінантним розладом ниркового кальційчутливого рецептора, що імітує ПГПТ [2]. Сімейна гіпокальційурична гіперкальціємія повинна розглядатися у пацієнтів із тривалою гіперкальціємією, рівнем кальцію в сечі менше 100 мг/24 години та відношенням кліренсу кальцію до креатиніну менше 0,01. Пацієнти з цим сімейним розладом мають помірну гіперкальціємію, незначну кількість симптомів, якщо вони взагалі є, відсутність ознак ураження інших органів внаслідок хвороби та відсутність користі від паратиреоїдектомії.
Такий погляд мають ендокринні хірурги на хірургічну патологію. Однак ендокринологам важливо розуміти підходи до пацієнтів із ГПТ, в яких немає гіперкальційурії на тлі нестачі вітаміну D, тобто із вторинним ГПТ.
Вторинний гіперпаратиреоз
Вторинний гіперпаратиреоз часто виникає внаслідок нестачі/дефіциту вітаміну D або за наявності іншого захворювання, порушення або прийому хімічних речовин (наприклад, тіазидних діуретиків), що спочатку спричиняє відносне зниження рівня кальцію у крові, яке згодом призводить до гіперплазії, аденоми та подальшої гіперфункції ПЩПЗ. ПТГ синтезується і секретується у відповідь на хронічно низький рівень кальцію в сироватці крові.
Часто в літературі можна прочитати, що причиною ВГПТ є порушення функції нирок. Однак це не зовсім правильно, оскільки найчастішою причиною ВГПТ є саме зниження концентрації вітаміну D у крові [2], а інші причини, у тому числі захворювання нирок, розглядаються значно рідше, обумовлюючи найтяжчий перебіг ураження ПЩПЗ.
ВГПТ може виникати при розвитку гіпокальціємії внаслідок зниженого засвоювання кальцію, всмоктування його в кишечнику, надмірної втрати кальцію нирками через використання петльових діуретиків або бісфосфонатів [10] (табл. 2).
ВГПТ може обтяжувати хронічну хворобу нирок, що характеризується високим рівнем ПТГ у сироватці крові, гіперплазією ПЩПЗ та порушенням мінерального обміну. Близько 60 % пацієнтів із хронічною хворобою нирок та 90 % хворих на гемодіалізі мають ВГПТ. Питанням ренального ГПТ присвячена дуже велика кількість англомовних публікацій, цим питанням переймаються переважно нефрологи, пацієнтів із таким захворюванням, на щастя, небагато (менше 1 % населення), тому в рамках цієї статті таку інформацію не розглядаємо.
Неренальний варіант нормокальціємічного гіперпаратиреозу
Розглянемо неренальний варіант нормокальціємічного гіперпаратиреозу, що стосується понад 96 % пацієнтів із патологією ПЩПЗ. У таких хворих наявні збільшення концентрації ПТГ у крові, нормальні рівні кальцію (загального, іонізованого), майже завжди первинно виявлений низький рівень вітаміну D (нижче 75 нмоль/л або 30 нг/мл), часто відмічається гіперплазія або аденома ПЩПЗ. Попри високу поширеність захворювань ПЩПЗ, майже немає публікацій та досліджень стосовно цієї проблеми. Зазвичай підвищений рівень ПТГ виявляється випадково при гормональному дослідженні, більшість лікарів не знає про значну поширеність патології ПЩПЗ (10–20 % — у дорослих, 30–70 % — у дітей та підлітків) і важливість підбору індивідуальних доз цього вітаміну-гормону. Ми вже зазначали, що більшість випадків вторинного нк-ГПТ пов’язана або перебігає на тлі нестачі/дефіциту вітаміну D. Характерною рисою ВГПТ, пов’язаного з нестачею/дефіцитом вітаміну D та ренальними захворюваннями, є поступове покращення показників та нівелювання порушень при призначенні адекватних доз цього вітаміну та додатковому усуненні недостатності бору і магнію, у деяких випадках — кальцію.
На сьогодні існуючі рекомендації сконцентровані переважно на профілактичних середньозважених щодо віку дозуваннях вітаміну D та мінімальній межі його потреб споживання. Проблема в тому, що вживання якоїсь дози вітаміну-гормону D — це одне, а прийом підібраної індивідуалізованої дози за показниками лабораторних досліджень із профілактичною або лікувальною метою — це зовсім інше. Різні пацієнти потребують застосування різних доз вітаміну-гормону D. Вживання будь-яких гормонів із часом потребує перегляду потреби у дозах. Використання вітаміну-гормону D із лікувальною метою при ГПТ буде правильним, якщо із самого початку, а потім впродовж всього періоду спостереження кожні 3–6 місяців будуть контролюватися такі лабораторні показники, як паратгормон, 25(OH)D, кальцій іонізований, магній, креатинін, інколи, за потребою, фосфор.
Маючи багаторічний досвід діагностування та лікування вторинного неренального нк-ГПТ, гіперплазій та аденом ПЩПЗ, пов’язаних із нестачею вітаміну D, підбору індивідуальних доз вітаміну-гормону D, рекомендуємо дотримуватись наступних підходів до діаг–ностики та лікування для досягнення довгострокової ефективності та безпеки.
Майже всі дослідження, які вивчали ефективність застосування вітаміну D із лікувальною (остеопенія/остеопороз) або профілактичною (онкоризики, цукровий діабет) метою, досягали клінічних цілей при застосуванні дози 5000 МО/щодня або більше. Менші дози не спрацьовували надійно, а дози менше 2000 МО/день зовсім не давали ефекту в дорослих осіб.
Наші спостереження показують потребу не лише в початковому підборі дози вітаміну D, а і, що є важливим, у досягненні ідеального рівня 25(OH)D у крові через 3–6 місяців, тобто дозування повинно бути індивідуалізоване, як і при будь-якій замісній гормональній терапії. Кращі результати лікування патології ПЩПЗ (ГПТ, аденоми та гіперплазії ПЩПЗ) досягаються при ідеальних рівнях 25(OH)D 100–150 нмоль/л (40–60 нг/мл). Найбільш надійні та відносно швидкі ефекти терапії такої патології спостерігалися у межах діапазону 120–160 нмоль/л (50–65 нг/мл). Результати лікування зазвичай оцінювали завдяки моніторингу даних УЗД ПЩПЗ та рівнів ПТГ вже через 6 місяців, але в деяких випадках період очікування досягнення мети розтягувався на декілька років. За умов такого сценарію важливим результатом було припинення прогресування захворювання з поступовим покращенням показників. Посилення ефективності та термінів терапії спостерігалося при одночасному додатковому щоденному використанні препаратів бору в дозі 3 мг. Також корисним може бути додавання препаратів магнію в дозі від 800 мг/добу.
Здебільшого лікування та моніторинг патології ПЩПЗ розтягуються на роки, часто потребують застосування підходів упродовж всього життя пацієнтів, навіть при досягненні ідеальних результатів (підтримуюча або профілактична терапія). Відміна або перерва в терапії/профілактиці може призвести до поновлення патологічних змін через певний час.
Дозування вітаміну D нами було описано в попередній статті [11]. Коротко можна сказати, що сьогодні вітамін D є визнаним гормоном, який впливає на всі метаболічні процеси й обумовлює стан здоров’я. Найчастіше використовують вітамін D у стартовій дозі 5000–6000 МО щодня протягом 2–3 місяців, потім переводячи пацієнтів на підтримуючі дози 2000–4000 МО/день, які вважаються безпечними. Можливим підходом до призначення вітаміну D є постійний прийом однієї фіксованої дози з наступним контролем 1 раз на 3–6 місяців (6 місяців є оптимальним терміном спостереження змін концентрації 25(OH)D у крові). Ще раз наголошуємо, у різних осіб існує різна потреба в дозах вітаміну-гормону D, не існує якогось універсального дозування, також воно може змінюватись із часом застосування та потребує періодичного контролю. В окремих випадках підтримуюча доза вітаміну-гормону D може становити 6000–7000 МО щодня. У разі ожиріння стартова доза може бути 10 000 МО щодня.
Гіперплазія та аденоми прищитоподібних залоз
У рамках розгляду нк-ГПТ існує окреме питання стосовно діагностування та диференціювання, ролі гіперплазій та аденом ПЩПЗ. Широке використання ультразвуку з високою роздільною здатністю призвело до збільшення виявлення інциденталом («випадкових») ПЩПЗ [12]. Ефективність візуалізації класичного розташування ПЩПЗ залежить лише від вміння, кваліфікації та уважності спеціаліста з УЗД. Незмінені ПЩПЗ неможливо відокремити від тканини ЩПЗ за розмірами, структурою та ехогенністю — вони наявні, але не візуалізуються. Тобто в разі, коли ПЩПЗ виявляються при проведенні УЗД, вони вже є зміненими, тільки тоді вони ідентифікуються та вдається виміряти їх розмір/об’єм.
Верхні ПЩПЗ зазвичай розташовані на задній стороні верхніх часток ЩПЗ, із незначними анатомічними варіаціями в популяції. Нижні ПЩПЗ розташовані вздовж латерального нижнього полюса ЩПЗ (вздовж трахеї), хоча вони можуть бути розташовані де завгодно між нижньою щелепою та верхнім середостінням. Частота інтратиреоїдного розташування ПЩПЗ становить приблизно 2 % [12]. У автопсійних дослідженнях у США серед пацієнтів без ПГПТ або захворювань ЩПЗ частоту аденом або гіперплазії ПЩПЗ виявляли в 1,9–7,6 % випадків [12, 13].
За даними хірургів, серед патологічних уражень ПЩПЗ, пов’язаних із первинним ГПТ, виявляють солітарну аденому у 80–85 % випадків, мультигландулярне ураження — у 15–20 % і карциному — у < 1 %. Зрозуміло, що така хірургічна статистика стосується гіперкальціємічного ГПТ (первинного, третинного). Наш досвід виявлення нормофункціональних ПЩПЗ та нк-ГПТ свідчить про наявність визначення гіпер–плазії ПЩПЗ у 70 % випадків та аденом — у 30 %, що зазвичай не потребують хірургічного лікування. Майже завжди такі нормокальціємічні зміни ПЩПЗ асоційовані з дефіцитом/нестачею вітаміну-гормону D, зазвичай піддаються помірно-ефективному лікуванню індивідуально підібраними дозами вітаміну D, що дозволяють утримувати рівні 25(OH)D у крові у межах 100–150 нмоль/л (40–60 нг/мл), краще — 120–160 нмоль/л (50–65 нг/мл), за умови довгострокового застосування. В деяких випадках покращення виявляється вже через 6 місяців, в інших відсутня динаміка продовж декількох років, без погіршення. Такий підхід у більшості випадків призводить до візуального зникнення ПЩПЗ при УЗД до покращення ультразвукових ознак патологічних змін ПЩПЗ, але дуже важливим є відсутність прогресування і розвитку ГПТ. Ця схема лікування є ефективною щодо нормофункціо–нуючих та гіпер–активних ПЩПЗ.
Хірургічний погляд на проблему вказує на те, що неактивні ПЩПЗ у пацієнтів із нормальним рівнем кальцію та паратгормону в сироватці крові вважаються ранньою стадією розвитку ПГПТ. Проте жодні проспективні дослідження не оцінювали, який відсоток нефункціонуючих ПЩПЗ із часом стає гіперсекреторним [12, 14].
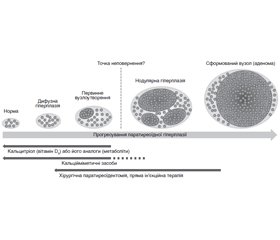
Це викликає значне здивування в ендокринологів, оскільки ми знаємо, що саме ВГПТ пов’язаний із нестачею/дефіцитом вітаміну D і може призводити до третинного ГПТ. Також ми знаємо, що гіперплазія — аденома ПЩПЗ — це стадійний процес, що може регресувати під дією лікування. Як бачимо з рис. 1, між нормальною ПЩПЗ та аденомою є відстань та час розвитку через етап гіперплазії.
Своєчасне лікування за рахунок вітаміну D, бору, магнію може сприяти відсутності прогресування пухлинного процесу, його регресу.
При ультразвуковому скануванні гіперплазія ПЩПЗ виглядає як ізоехогенна або помірно гіпоехогенна тканина, частіше овальної форми, однорідна, із чітким або нечітким контуром, що може оптично зливатися з тканиною ЩПЗ. За відсутності напруження в кальцієвій системі при УЗД не можна відокремити ПЩПЗ від ЩПЗ. Аденоми ПЩПЗ частіше однорідні, гіпоехогенні, більш округлі, ніж гіперплазії. Для ГПТ більш характерним є наявність значно гіпоехогенних (майже анехогенних) округлих ПЩПЗ, у деяких випадках неоднорідної структури. У дуже рідкісних випадках можливі кістозні зміни або внутрішні кальцинати. Найімовірніше, аденоми ПЩПЗ є ізольованими, солітарними. Однак при синдромі множинної ендокринної неоплазії можуть спостерігатися множинні аденоми ПЩПЗ або вони поєднуються з ендокринними пухлинами інших локалізацій.
/67.jpg)
Оцінка за допомогою кольорового допплера є фундаментальною, коли підозрюється аденома ПЩПЗ, оскільки зазвичай можна виявити, де живить артерія, гілка нижньої щитоподібної артерії, що входить в аденому по одному з полюсів і поширюється до периферії. Цей екстранодулярний рисунок, відомий як «судинна дуга», допомагає диференціювати його від лімфатичних вузлів або пухлинних уражень, васкуляризація яких буде більш центральною інтранодулярною [16].
Маючи досвід діагностування та лікування гіперплазій та аденом ПЩПЗ (декілька тисяч пацієнтів) за останні 10 років, стверджуємо, що відсутня будь-яка залежність між розміром ПЩПЗ та їх функціональним станом. Гіпоехогенна ПЩПЗ розміром 3 мм може секретувати значно більшу кількість ПТГ, ніж ізоехогенна або помірно гіпоехогенна еупаратиреоїдна ПЩПЗ розміром 10–30 мм.
Таким чином, патологія ПЩПЗ є поширеною серед населення (10–20 % — у дорослих, 30–70 % — у дітей та підлітків), а головним чинником цього є недостатнє вживання вітаміну D. Застосування індивідуально підібраних доз вітаміну D, які дозволяють утримувати його рівні в межах ідеального діапазону (25(OH)D 100–150 нмоль/л (40–60 нг/мл)) протягом тривалого часу, дозволяє не тільки профілактувати появу захворювань ПЩПЗ, але й ефективно лікувати їх, включаючи ВГПТ.
Патологія ПЩПЗ є стадійним патологічним процесом, що проходить декілька етапів: на початку внаслідок напруження у кальцієвій системі овальні ПЩПЗ стають візуалізованими при УЗД, відокремленими від тканини ЩПЗ, потім виникає гіперплазія. У подальшому гіперплазовані ПЩПЗ починають змінюватися, визначається зниження їх ехогенності, що посилюється з часом. Із часом вузлова трансформація змінених ПЩПЗ може виявлятися збільшенням розмірів, неоднорідністю тканини та округлою сферичністю (форма шару). Паралельно за рахунок патологічних змін і як компенсаторна реакція на нестачу/дефіцит вітаміну D поступово виявляється збільшення концентрації ПТГ у сироватці крові (стадія ВГПТ). У майбутньому за відсутності адекватного лікування та профілактики гіперпаратиреозу приєднується гіперкальціємія (стадія ПГПТ або ТГПТ), що може вже потребувати хірургічного втручання.
Єдиний шлях усунення поступового прогресування розладів ПЩПЗ — застосування індивідуальних профілактичних або лікувальних доз вітаміну D.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 25.07.2022
Рецензовано/Revised 31.08.2022
Прийнято до друку/Accepted 21.09.2021

/63.jpg)
/65.jpg)
/67.jpg)