Международный эндокринологический журнал Том 19, №1, 2023
Вернуться к номеру
Механізми ренопротекторної дії інгібіторів натрійзалежного котранспортера глюкози 2-го типу (гліфлозинів): погляд клініциста
Авторы: Лутай Я.М., Пархоменко О.М.
Державна установа «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені акад. М.Д. Стражеска НАМН України», м. Kиїв, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
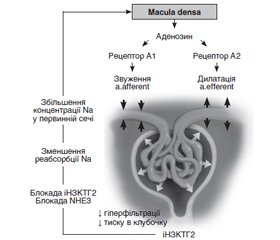
Інгібітори натрійзалежного котранспортера глюкози 2-го типу (іНЗКТГ2) — це група препаратів, що блокують фермент, який відповідає за реабсорбцію глюкози і натрію в проксимальній частині нефрону. Вони використовуються в клінічній практиці близько десяти років для лікування цукрового діабету 2-го типу (ЦД2), але перші ж клінічні дослідження показали потенційні можливості цих засобів щодо запобігання серцево-судинним і нирковим подіям. На сьогодні серед основних механізмів ренопротекторної дії іНЗКТГ2 виділяють: 1) зменшення гіперфільтрації/тиску в клубочку (звуження приносної і розширення виносної артеріол); 2) метаболічний зсув у бік використання вільних жирних кислот для отримання енергії (підвищення енергоефективності та зменшення ліпотоксичного пошкодження клітин); 3) антигіпоксичний ефект (прямий — через зменшення потреб у кисні й опосередкований — через збільшення гемоглобіну); 4) зниження перевантаження тиском і рідиною; 5) протизапальний і антифібротичний вплив; 6) інші ефекти (зниження глікемії, маси тіла, зниження рівня сечової кислоти тощо). Імовірно, призначення іНЗКТГ2 викликає універсальну клітинну реакцію (автофагія), що призводить до поліпшення енергоефективності, зменшує клітинний стрес і підвищує стійкість клітин до перевантаження. Значимість різних механізмів у формуванні загального ефекту розрізняється залежно від основної причини ураження нирок, супутньої патології, метаболічних особливостей пацієнта, ступеня ішемії нирки тощо. Вона різниться не тільки в кожного окремого пацієнта, але, імовірно, в одного й того самого пацієнта на різних стадіях захворювання. Утім, реалізація цих механізмів дозволяє запобігти розвитку/прогресуванню ниркової недостатності й подовжити життя пацієнтів.
Sodium-glucose cotransporter-2 inhibitors (SGLT2i) are a group of drugs that block the enzyme responsible for the reabsorption of glucose and sodium in the proximal part of the nephron. They appeared in clinical practice about a decade ago for the treatment of type 2 diabetes mellitus, but the first clinical studies showed the potential of these agents in preventing cardiovascular and renal events. Among the main mechanisms of the renoprotective effect of SGLT2i, the following are distinguished now: 1) reduction of hyperfiltration/pressure in the glomerulus (narrowing of the afferent and dilation of the efferent arterioles); 2) metabolic shift towards the use of free fatty acids for obtaining energy (increasing energy efficiency and reducing lipotoxic damage to cells); 3) antihypoxic effect (direct — due to a decrease in oxygen needs and indirect — due to an increase in hemoglobin); 4) reduction of pressure and fluid overload; 5) anti-inflammatory and antifibrotic effects; 6) other effects (decrease in glycaemia, body weight, uric acid level, etc.). Presumably, SGLT2i administration causes a universal cellular reaction (autophagic flux), which leads to improved energy efficiency, reduces cellular stress and increases the resistance of cells to overload. The significance of various mechanisms in the formation of the overall effect differs depending on the main cause of kidney damage, concomitant pathology, metabolic characteristics of the patient, degree of kidney ischemia, etc. It is different not only in each individual patient, but, probably, in the same patient at different stages of the disease. However, the implementation of these mechanisms allows preventing the development/progression of kidney failure and prolonging the life of patients.
інгібітори натрійзалежного котранспортера глюкози 2-го типу; механізми ренопротекторної дії; клубочкова гіперфільтрація; хронічна хвороба нирок; профілактика
sodium-glucose cotransporter-2 inhibitors; mechanisms of renoprotection; glomerular hyperfiltration; chronic kidney disease; prevention
/50.jpg)
- Kluger A.Y., Tecson K.M., Barbin C.M., Lee A.Y., Lerma E.V., Rosol Z.P., Rangaswami J., Lepor N.E., Cobble M.E., McCul–lough P.A. Cardiorenal Outcomes in the CANVAS, DECLARE-TIMI 58, and EMPA-REG OUTCOME Trials: A Systematic Review. Rev. Cardiovasc. Med. 2018 Jun 30. 19(2). 41-49. doi: 10.31083/j.rcm.2018.02.907.
- McMurray J.J.V., Solomon S.D., Inzucchi S.E., Køber L., Kosiborod M.N., Martinez F.A. et al.; DAPA-HF Trial Committees and Investigators. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N. Engl. J. Med. 2019 Nov 21. 381(21). 1995-2008. doi: 10.1056/NEJMoa1911303.
- Heerspink H.J.L., Stefánsson B.V., Correa-Rotter R., Chertow G.M., Greene T., Hou F.F. et al.; DAPA-CKD Trial Committees and Investigators. Dapagliflozin in Patients with Chronic Kidney Di–sease. N. Engl. J. Med. 2020 Oct 8. 383(15). 1436-1446. doi: 10.1056/NEJMoa2024816.
- Brenner B.M., Lawler E.V., Mackenzie H.S. The hyperfiltration theory: a paradigm shift in nephrology. Kidney Int. 1996 Jun. 49(6). 1774-7. doi: 10.1038/ki.1996.265.
- Cherney D.Z., Perkins B.A., Soleymanlou N., Maione M., Lai V., Lee A. et al. Renal hemodynamic effect of sodium-glucose cotransporter 2 inhibition in patients with type 1 diabetes mellitus. Circulation. 2014 Feb 4. 129(5). 587-97. doi: 10.1161/CIRCULATIONAHA.113.005081.
- Onishi A., Fu Y., Patel R., Darshi M., Crespo-Masip M., Huang W. et al. A role for tubular Na+/H+ exchanger NHE3 in the natriuretic effect of the SGLT2 inhibitor empagliflozin. Am. J. Physiol. Renal. Physiol. 2020 Oct 1. 319(4). F712-F728. doi: 10.1152/ajprenal.00264.2020.
- Van Bommel E.J.M., Muskiet M.H.A., van Baar M.J.B., Tonneijck L., Smits M.M., Emanuel A.L. et al. The renal hemodynamic effects of the SGLT2 inhibitor dapagliflozin are caused by post-glomerular vasodilatation rather than pre-glomerular vasoconstriction in metformin-treated patients with type 2 diabetes in the randomized, double-blind RED trial. Kidney Int. 2020 Jan. 97(1). 202-212. doi: 10.1016/j.kint.2019.09.013.
- Kraus B.J., Weir M.R., Bakris G.L., Mattheus M., Cherney D.Z.I., Sattar N. et al. Characterization and implications of the initial estimated glomerular filtration rate ‘dip’ upon sodium-glucose cotransporter-2 inhibition with empagliflozin in the EMPA-REG OUTCOME trial. Kidney Int. 2021 Mar. 99(3). 750-762. doi: 10.1016/j.kint.2020.10.031.
- Adamson C., Docherty K.F., Heerspink H.J.L., de Boer R.A., Damman K., Inzucchi S.E. et al. Initial Decline (Dip) in Estimated Glomerular Filtration Rate After Initiation of Dapagliflozin in Patients With Heart Failure and Reduced Ejection Fraction: Insights From DAPA-HF. Circulation. 2022 Aug 9. 146(6). 438-449. doi: 10.1161/CIRCULATIONAHA.121.058910.
- McCallum W., Tighiouart H., Ku E., Salem D., Sarnak M.J. Trends in Kidney Function Outcomes Following RAAS Inhibition in Patients With Heart Failure With Reduced Ejection Fraction. Am. J. Kidney Dis. 2020 Jan. 75(1). 21-29. doi: 10.1053/j.ajkd.2019.05.010.
- McCausland F.R., Lefkowitz M.P., Claggett B., Packer M., Senni M., Gori M. et al. Angiotensin-neprilysin inhibition and renal outcomes across the spectrum of ejection fraction in heart failure. Eur. J. Heart Fail. 2022 Sep. 24(9). 1591-1598. doi: 10.1002/ejhf.2421.
- Bobulescu I.A. Renal lipid metabolism and lipotoxicity. Curr. Opin. Nephrol. Hypertens. 2010 Jul. 19(4). 393-402. doi: 10.1097/MNH.0b013e32833aa4ac.
- Kang H.M., Ahn S.H., Choi P., Ko Y.A., Han S.H., Chinga F. et al. Defective fatty acid oxidation in renal tubular epithelial cells has a key role in kidney fibrosis development. Nat. Med. 2015 Jan. 21(1). 37-46. doi: 10.1038/nm.3762.
- Ferrannini E., Muscelli E., Frascerra S., Baldi S., Mari A., Heise T. et al. Metabolic response to sodium-glucose cotransporter 2 inhibition in type 2 diabetic patients. J. Clin. Invest. 2014 Feb. 124(2). 499-508. doi: 10.1172/JCI72227.
- Mather A., Pollock C. Glucose handling by the kidney. Kidney Int. Suppl. 2011 Mar. (120). S1-6. doi: 10.1038/ki.2010.509.
- Feng Y.Z., Ye Y.J., Cheng Z.Y., Hu J.J., Zhang C.B., Qian L. et al. Non-invasive assessment of early stage diabetic nephropathy by DTI and BOLD MRI. Br. J. Radiol. 2020 Jan. 93(1105). 20190562. doi: 10.1259/bjr.20190562.
- Laursen J.C., Søndergaard-Heinrich N., de Melo J.M.L., Haddock B., Rasmussen I.K.B., Safavimanesh F. et al. Acute effects of dapagliflozin on renal oxygenation and perfusion in type 1 diabetes with albuminuria: A randomised, double-blind, placebo-controlled crossover trial. EClinicalMedicine. 2021 Jun 28. 37. 100895. doi: 10.1016/j.eclinm.2021.100895.
- Cai T., Ke Q., Fang Y., Wen P., Chen H., Yuan Q. et al. Sodium-glucose cotransporter 2 inhibition suppresses HIF-1α-mediated metabolic switch from lipid oxidation to glycolysis in kidney tubule cells of diabetic mice. Cell. Death Dis. 2020 May 22. 11(5). 390. doi: 10.1038/s41419-020-2544-7.
- Durante W., Behnammanesh G., Peyton K.J. Effects of Sodium-Glucose Co-Transporter 2 Inhibitors on Vascular Cell Function and Arterial Remodeling. Int. J. Mol. Sci. 2021 Aug 16. 22(16). 8786. doi: 10.3390/ijms22168786.
- Mazidi M., Rezaie P., Gao H.K., Kengne A.P. Effect of So–dium-Glucose Cotransport-2 Inhibitors on Blood Pressure in People With Type 2 Diabetes Mellitus: A Systematic Review and Meta-Analysis of 43 Randomized Control Trials With 22 528 Patients. J. Am. Heart Assoc. 2017 May 25. 6(6). e004007. doi: 10.1161/JAHA.116.004007.
- Heerspink H.J., Perkins B.A., Fitchett D.H., Husain M., Cherney D.Z. Sodium Glucose Cotransporter 2 Inhibitors in the Treatment of Diabetes Mellitus: Cardiovascular and Kidney Effects, Potential Mechanisms, and Clinical Applications. Circulation. 2016 Sep 6. 134(10). 752-72. doi: 10.1161/CIRCULATIONAHA.116.021887.
- Scholtes R.A., Muskiet M.H.A., van Baar M.J.B., Hesp A.C., Greasley P.J., Karlsson C. et al. Natriuretic Effect of Two Weeks of Dapagliflozin Treatment in Patients With Type 2 Diabetes and Preserved Kidney Function During Standardized Sodium Intake: Results of the DAPASALT Trial. Diabetes Care. 2021 Feb. 44(2). 440-447. doi: 10.2337/dc20-2604.
- Verma S., McMurray J.J.V. SGLT2 inhibitors and mechanisms of cardiovascular benefit: a state-of-the-art review. Diabetologia. 2018 Oct. 61(10). 2108-2117. doi: 10.1007/s00125-018-4670-7.
- Herat L.Y., Magno A.L., Rudnicka C., Hricova J., Carnagarin R., Ward N.C. et al. SGLT2 Inhibitor-Induced Sympathoinhibition: A Novel Mechanism for Cardiorenal Protection. JACC Basic Transl. Sci. 2020 Jan 29. 5(2). 169-179. doi: 10.1016/j.jacbts.2019.11.007.
- Ye N., Jardine M.J., Oshima M., Hockham C., Heerspink H.J.L., Agarwal R. et al. Blood Pressure Effects of Canagliflozin and Clinical Outcomes in Type 2 Diabetes and Chronic Kidney Disease: Insights From the CREDENCE Trial. Circulation. 2021 May 4. 143(18). 1735-1749. doi: 10.1161/CIRCULATIONAHA.120.048740.
- Heerspink H.J.L., Perco P., Mulder S., Leierer J., Hansen M.K., Heinzel A., Mayer G. Canagliflozin reduces inflammation and fibrosis biomarkers: a potential mechanism of action for beneficial effects of SGLT2 inhibitors in diabetic kidney disease. Diabetologia. 2019. 62(7). 1154-1166. doi: 10.1007/s00125-019-4859-4.
- Novikov A., Fu Y., Huang W., Freeman B., Patel R., van Ginkel C. et al. SGLT2 inhibition and renal urate excretion: role of luminal glucose, GLUT9, and URAT1. Am. J. Physiol. Renal Physiol. 2019 Jan 1. 316(1). F173-F185. doi: 10.1152/ajprenal.00462.2018.
- Yip A.S.Y., Leong S., Teo Y.H., Teo Y.N., Syn N.L.X., See R.M. et al. Effect of sodium-glucose cotransporter-2 (SGLT2) inhibitors on serum urate levels in patients with and without diabetes: a systematic review and meta-regression of 43 randomized controlled trials. Ther. Adv. Chronic Dis. 2022 Mar 23. 13. 20406223221083509. doi: 10.1177/20406223221083509.
- Schork A., Saynisch J., Vosseler A., Jaghutriz B.A., Heyne N., Peter A. et al. Effect of SGLT2 inhibitors on body composition, fluid status and renin-angiotensin-aldosterone system in type 2 diabetes: a prospective study using bioimpedance spectroscopy. Cardiovasc. Diabetol. 2019 Apr 5. 18(1). 46. doi: 10.1186/s12933-019-0852-y.
- Mulyadi L., Stevens C., Munro S., Lingard J., Bermingham M. Body fat distribution and total body fat as risk factors for microalbuminuria in the obese. Ann. Nutr. Metab. 2001. 45(2). 67-71. doi: 10.1159/000046708.
- Packer M. Role of Deranged Energy Deprivation Signaling in the Pathogenesis of Cardiac and Renal Disease in States of Perceived Nutrient Overabundance. Circulation. 2020 Jun 23. 141(25). 2095-2105. doi: 10.1161/CIRCULATIONAHA.119.045561.
- Packer M. Critical Reanalysis of the Mechanisms Underlying the Cardiorenal Benefits of SGLT2 Inhibitors and Reaffirmation of the Nutrient Deprivation Signaling/Autophagy Hypothesis. Circulation. 2022 Nov. 146(18). 1383-1405. doi: 10.1161/CIRCULATIONAHA.122.061732.
- Yang L., Liang B., Li J., Zhang X., Chen H., Sun J., Zhang Z. Dapagliflozin alleviates advanced glycation end product induced podocyte injury through AMPK/mTOR mediated autopha–gy pathway. Cell. Signal. 2022 Feb. 90. 110206. doi: 10.1016/j.cellsig.2021.110206.
- Faridvand Y., Kazemzadeh H., Vahedian V., Mirzajanzadeh P., Nejabati H.R., Safaie N. et al. Dapagliflozin attenuates high glucose-induced endothelial cell apoptosis and inflammation through AMPK/SIRT1 activation. Clin. Exp. Pharmacol. Physiol. 2022 Jun. 49(6). 643-651. doi: 10.1111/1440-1681.13638.

/52.jpg)