Международный эндокринологический журнал Том 19, №5, 2023
Вернуться к номеру
Використання левотироксину в лікуванні гіпотиреозу: історична перспектива
Авторы: G.J. Kahaly (1), U. Gottwald-Hostalek (2)
(1) — Department of Medicine I, Johannes Gutenberg University (JGU) Medical Center, Mainz, Germany
(2) — Research and Development, Merck Healthcare KGaA, Darmstadt, Germany
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
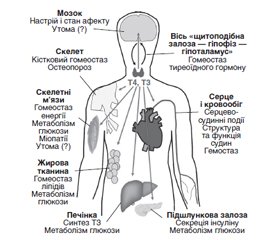
Щитоподібна залоза функціонує в складній системі регуляції гомеостазу, де рівень тиреотропіну (ТТГ) впливає на швидкість секреції основних тиреоїдних гормонів тироксину (Т4) і трийодтироніну (Т3). Згубні наслідки нелікованої дисфункції щитоподібної залози були доведені протягом століть. Дійсно, кілька століть тому у джерелах описували зоб і кретинізм — два клінічні наслідки нелікованого явного захворювання щитоподібної залози. Лише в першій половині XIX століття зоб і кретинізм вперше почали асоціювати з йодним статусом; однак ендокринна функція щитоподібної залози не була чітко визначена до початку XX століття. Три головні інновації XX століття, які підтримали використання левотироксину (LT4) як замісної терапії для лікування гіпотиреозу, — це практична методика синтезу LT4, придатного для фармацевтичного використання (кінець 1940-х років), відкриття перетворення LT4 на активний гормон щитоподібної залози, Т3, у периферичних тканинах (1970), а також розробка надійної та чутливої методології аналізу для вимірювання тиреоїдних гормонів у крові (1960 рік і пізніше). Синтетичний LT4, титрований для приведення рівня ТТГ у попередньо визначений «нормальний» референсний діапазон, тепер вважається основою лікування гіпотиреозу й забезпечує адекватне відновлення функції гормонів щитоподібної залози в більшості людей із цим захворюванням. У подальших дослідженнях будуть вивчати нюанси осі «гіпоталамус — гіпофіз — щитоподібна залоза», а також місце Т3 у лікуванні дисфункції щитоподібної залози.
The thyroid operates within a complex system of homeostatic regulation, where the level of thyrotropin (TSH) influences the rate of secretion of the principal thyroid hormones, thyroxine (T4) and triiodothyronine (T3). The devastating consequences of untreated thyroid dysfunction have been evident for centuries. Indeed, sources from antiquity described goitre and cretinism, two of the clinical sequelae of untreated overt thyroid disease. It was not until the first part of the 19th century that goitre and cretinism were first associated with iodine status; however, the endocrine function of the thyroid was not clearly identified until the early part of the 20th century. Three principal innovations in the 20th century supported the use of levothyroxine (LT4) replacement therapy for the management of hypothyroidism: a practical technique for the synthesis of LT4 suitable to support pharmaceutical use (late 1940s), the discovery that LT4 is converted to the active thyroid hormone, T3, in the peripheral tissues (1970), and the development of robust and sensitive assay methodology for measuring thyroid hormones in the blood (1960 onwards). Synthetic LT4, titrated to bring the level of TSH within a predefined “normal” reference range, is now established as the mainstay of treatment for hypothyroidism, and provides adequate restoration of thyroid hormone function for most people with this condition. Future research will explore further the nuances of the hypothalamic-pituitary-thyroid axis, and the place, if any, for T3 within the management of thyroid dysfunction.
левотироксин; тироксин; гіпотиреоз; щитоподібна залоза; історія медицини
levothyroxine; thyroxine; hypothyroidism; thyroid gland; history of medicine
Вступ. Сучасне лікування гіпотиреозу
/112.jpg)
Визначення ролі щитоподібної залози
Дивлячись уперед
Висновки
- Hoermann R., Midgley J.E., Larisch R., Dietrich J.W. Homeostatic control of the thyroid-pituitary axis: Perspectives for diagnosis and treatment. Front. Endocrinol. 2015. 6. 177. doi: 10.3389/fendo.2015.00177.
- Hennessey J.V. Therapeutic actions of levothyroxine, in: ‘70 years oflevothyroxine’. Cham, Switzerland: Springer Nature Switzerland AG. Available at: https://link.springer. com/book/10.1007/978-3-030-63277-9 (Accessed September 2022).
- Okosieme O., Gilbert J., Abraham P., Boelaert K., Dayan C., Gurnell M. et al. Management of primary hypothyroidism: statement by the British thyroid association executive committee. Clin. Endocrinol. 2016. 84. 799-808. doi: 10.1111/cen.12824.
- National Institute for Health and Care Excellence. Clinical knowledge summaries. Hypothyroidism. Last revised in June. 2018. Available at: https://cks.nice.org.uk/hypothyroidism (Accessed March 2019).
- Jonklaas J., Bianco A.C., Bauer A.J., Burman K.D., Cappola A.R., Celi F.S. et al. Guidelines for the treatment of hypothyroidism: prepared by the American thyroid association task force on thyroid hormone replacement. Thyroid. 2014. 24. 1670751. doi: 10.1089/thy.2014.0028.
- Sheehan M.T. Biochemical testing of the thyroid: TSH is the best and, oftentimes, only test needed — a review for primary care. Clin. Med. Res. 2016. 14. 83-92. doi: 10.3121/cmr.2016.1309.
- Pearce S.H., Brabant G., Duntas L.H., Monzani F., Pee–ters R.P., Razvi S. et al. 2013 ETA Guideline: management of subcli–nical hypothyroidism. Eur. Thyroid. J. 2013. 2. 215-28. doi: 10.1159/ 000356507.
- Chaker L., Razvi S., Bensenor I.M., Azizi F., Pearce E.N., Peeters R.P. Hypothyroidism. Nat. Rev. Dis. Primers. 2022. 8. 30. doi: 10.1038/s41572-022-00357-7.
- Lindholm J., Laurberg P. Hypothyroidism and thyroid substitution: historical aspects. J. Thyroid Res. 2011. 2011. 809341. doi: 10.4061/2011/809341.
- McAninch E.A., Bianco A.C. The history and future of treatment of hypothyroidism. Ann. Intern. Med. 2016. 164. 50-6. doi: 10.7326/M15-1799.
- Slater S. The discovery of thyroid replacement therapy. part 1: In the beginning. J. R. Soc. Med. 2011. 104. 15-8. doi: 10.1258/jrsm.2010.10k050.
- Sterpetti A.V. How the art in Rome represented persona–ges with goitre. Eur. J. Intern. Med. 2016. 32. e28-9. doi: 10.1016/j.ejim.2016.03.023.
- Trinca F., Riva M.A. The representation of a goiter by renaissance painter Moretto Dabrescia. J. Endocrinol. Invest. 2019. 42. 1133-4. doi: 10.1007/s40618-019-01023-8.
- Sterpetti A.V., Fiori E., De Cesare A. Goiter in the art of renaissance Europe. Am. J. Med. 2016. 129. 892-5. doi: 10.1016/j.amjmed.2016.04.015.
- Vescia F.G., Basso L. Goiters in the Renaissance. Vesalius. 1997. 3. 23-32.
- Ferriss J.B. The many reasons why goiter is seen in old pain–tings. Thyroid. 2008. 18. 387-93. doi: 10.1089/thy.2007.0301.
- Niazi A.K., Kalra S., Irfan A., Islam A. Thyroidology over the ages. Indian J. Endocrinol. Metab. 2011. 15 (Suppl. 2). S121-6. doi: 10.4103/2230-8210.83347.
- Alexander J.L., Astill P.H., Emerson J.W., Evans S.M., Harcus A.W., Holden J.S. et al. Derbyshire Neck. Thyroid abnormalities in the Derbyshire peak district. Lancet. 1966. 2. 959-61. doi: 10.1016/S0140-6736(66)90556-3.
- Curling T.B. Two cases of absence of the thyroid body, and symmetrical swellings of fat tissue at the sides of the neck, connec–ted with defective cerebral development. Med. Chir. Trans. 1850. 33. 303-6. doi: 10.1177/095952875003300123.
- Fagge C.H. On sporadic cretinism, occurring in England. Med. Chir. Trans. 1871. 54. 55-169. doi: 10.1177/0959528771054 00108.
- Pearce J.M. Myxoedema and sir William Withey Gull (1816–1890). J. Neurol. Neurosurg. Psychiatry. 2006. 77. 639. doi: 10.1136/jnnp.2005.082198.
- Ord W.M. On myxredema, a term proposed to be applied to an essential condition in the “Cretinoid” affection occasionally observed in middle-aged women. Med. Chir. Trans. 1878. 61. 57-78. doi: 10.1177/095952877806100107.
- Hirsch A. Handbook of geographical and historical pathology: Vol. II. London: New Sydenham Society, 1885.
- Horsley V. On the function of the thyroid gland. Proc. R. Soc. Lond. 1885. 38. 5-7. doi: 10.1098/rspl.1884.0054.
- Schiff M. Resume d’une nouvelle serie d’experiences sur les effets de l’ablation des corps thyroides. In: Revue médicale de la suisse romande (Geneve: Imprimerie Charles Schuchardt). Vol. 4. 1884. P. 425-45.
- Kocher T. Ueber kropf exstirpation und ihre folgen. Archiv Klinische Chirurgie. 1883. 29. 254-335.
- Zimmermann M.B. Research on iodine deficiency and goiter in the 19th and early 20th centuries. J. Nutr. 2008. 138. 2060-3. doi: 10.1093/jn/138.11.2060.
- Coindet J.F. Nouvelles recherches sur les effets de l’iode et sur les precautions a suivre dans le traitement du goitre par ce nouveau remede. Ann. Chim. Phys. 1821. 16 (Ser. 2). 345-56.
- Chatin A. Recherches sur l’iode des eaux douces) de la pre–sence de ce corps dans les plantes at les animaux terrestes. In: Comptes rendus hebdomadaires des seances de l’Academie des sciences (Paris: Gauthier-Villars). Vol. 31. 1851. P. 280-3.
- Doyle L. Myxoedema: Some early reports and contributions by British authors, 1873-1898. J. R. Soc. Med. 1991. 84. 103-6. doi: 10.1177/014107689108400216.
- Murray G.R. The life-history of the first case of myxoedema treated by thyroid extract. Br. Med. J. 1920. 3089. 359-60. doi: 10.1136/bmj.1.3089.359.
- Beadles C.F. The treatment of myxredema and cretinism, being a review of the treatment of these diseases with the thyroid gland, with a table of 100 published cases. J. Ment. Sci. 1893. 39. 509-36. doi: 10.1192/bjp.39.167.509.
- Baumann E. Ueber das normale vorkommen von jod im thierkorper. Hoppe-Seyler’s Z fur Physiologische Chemie. 1895. 21. 319-30. doi: 10.1515/bchm2.1896.21.4.3191.
- Ahmed A.M., Ahmed N.H. History of disorders of thyroid dysfunction. East Mediterr Health J. 2005. 11. 459-69. doi: 10.26719/2005.11.3.459.
- Kendall E.C. The isolation in crystalline form of the compound containing iodin, which occurs in the thyroid: Its chemical nature and physiologic activity. J. Am. Med. Ass. 1915. 64. 2042-3. doi: 10.1001/jama.1915.02570510018005.
- Bramwell B. The thyroid treatment of myxoedema and sporadic cretinism, with notes of twenty-three cases of myxoedema and five cases of sporadic cretinism, treated by thyroid extract. Edinburgh Hosp. Rep. 1895. 3. 116-249.
- Harington C.R., Barger G. Chemistry of thyroxine. III: Constitution and synthesis of thyroxine. Biochem. J. 1927. 21. 169-83. doi: 10.1042/bj0210169.
- Chalmers J.R., Dickson G.T., Elks J., Hems B.A. The synthesis of thyroxine and related substances. Part V. A synthesis of l-thyro–xine from l-tyrosine. J. Chem. Soc. 1949. 3424-38.
- Mateo R.C.I., Hennessey J.V. Thyroxine and treatment of hypothyroidism: seven decades of experience. Endocrine. 2019. 66. 10-7. doi: 10.1007/s12020-019-02006-8.
- Braverman L.E., Ingbar S.H., Sterling K. Conversion of thyroxine (T4) to triiodothyronine (T3) in 42 athyreotic human subjects. J. Clin. Invest. 1970. 49. 855-64. doi: 10.1172/JCI106304.
- Steegborn C., Schweizer U. Structure and mechanism of iodo–thyronine deiodinases — what we know, what we don’t know, and what would be nice to know. Exp. Clin. Endocrinol. Diabetes. 2020. 128. 375-8. doi: 10.1055/a-1022-9916.
- Tata J.R. Rosalind Pitt-rivers and the discovery of T3. Trends. Biochem. Sci. 1990. 15. 282-4. doi: 10.1016/0968-0004(90)90055-g.
- Spencer C.A. Assay of thyroid hormones and related substan–ces. Available at: https://www.ncbi.nlm.nih.gov/books/NBK279113/ (Accessed March 2020).
- Kuy J.M. The evolution of thyroid function tests. J. Endocrinol. Metab. Diabetes. S. Afr. 2015. 20. 11-6. doi: 10.1080/16089677. 2015.1056468.
- Medicines and health regulatory authority. levothyroxine tablet products: a review ofclinical & quality considerations. 2013. Available at: http://webarchive.nationalarchives.gov.uk/20141205150130/http:/www.mhra.gov.uk/home/groups/pl-p/documents/drugsafetymessage/con222566.pdf (Accessed September 2018).
- Agence francaise de secrurite sanitaire des produits de sante, in: Commission nationale de pharmacovigilance. compte re–ndu de la reunion du mardi. 2012. Available at: https://ansm.sante.fr/var/ansm_site/storage/original/application/4e4d2a70e5dddfb150fe87360d6b13dd.pdf (Accessed September 2012).
- The united states pharmacopeial convention 2009 current USP monograph of levothyroxine sodium tablets (published in revision bulletin, official February 1, 2010). Available at: https://www.uspnf.com/sites/default/files/usp_pdf/EN/USPNF/levothyroxineSodiumTablets.pdf (Accessed September 2010).
- Gottwald-Hostalek U., Uhl W., Wolna P., Kahaly G.J. New levothyroxine formulation meeting 95-105% specification over the whole shelf-life: results from two pharmacokinetic trials. Curr. Med. Res. Opin. 2017. 33. 169-74. doi: 10.1186/s12902-019-0365-4.
- Lipp H.P., Hostalek U. A new formulation of levothyroxine engineered to meet new specification standards. Curr. Med. Res. Opin. 2019. 35.147-50. doi: 10.1159/000339444.
- Clin. Calc. Drug. Stats. Database. Available at: https://clincalc.com/DrugStats/Default.aspx (Accessed September 2022).
- Hennessey J.V., Espaillat R. Current evidence for the treatment of hypothyroidism with levothyroxine/levotriiodothyronine combination therapy versus levothyroxine monotherapy. Int. J. Clin. Pract. 2018. 72. e13062. doi: 10.1080/03007995.2021.1984219.
- Midgley J.E.M., Toft A.D., Larisch R., Dietrich J.W., Hoermann R. Time for a reassessment of the treatment of hypothyroidism. B.M.C. Endocr. Disord. 2019. 19. 37. doi: 10.1530/EC-20-0205.
- Wiersinga W.M., Duntas L., Fadeyev V., Nygaard B., Vanderpump M.P. 2012. E.T.A. Guidelines: The use of l-T4 + l-T3 in the treatment of hypothyroidism. Eur. Thyroid. J. 2012. 1. 55-71. doi: 10.1159/000339444.
- DiStefano J. 3rd, Jonklaas J. Predicting optimal combination LT4 + LT3 therapy for hypothyroidism based on residual thyroid function. Front. Endocrinol. 2019. 10. 746. doi: 10.3389/fendo.2019.00746.
- Gottwald-Hostalek U., Kahaly G.J. Triiodothyronine alongside levothyroxine in the management of hypothyroidism? Curr. Med. Res. Opin. 2021. 37. 2099-106. doi: 10.1530/EJE-12-0627.
- Razvi S., Mrabeti S., Luster M. Managing symptoms in hypothyroid patients on adequate levothyroxine: a narrative review. Endocr. Connect. 2020. 9. R241-50. doi: 10.1210/jc.2003-031641.
- Bianco A.C. Cracking the code for thyroid hormone signaling. Trans. Am. Clin. Climatol. Assoc. 2013. 124. 26-35.
- Peeters R.P., Visser T.J. Metabolism ofthyroid hormone. Available at: https://www.ncbi.nlm.nih.gov/books/NBK285545 (Accessed February 2020).
- Biondi B. Mechanisms in endocrinology: Heart failure and thyroid dysfunction. Eur. J. Endocrinol. 2012. 167. 609-18. doi: 10.1210/jc.2003-031641.
- Hansen P.S., Brix T.H., Sorensen T.I., Kyvik K.O., Hegedus L. Major genetic influence on the regulation of the pituitary-thyroid axis: a study of healthy Danish twins. J. Clin. Endocrinol. Metab. 2004. 89. 1181-87. doi: 10.1210/jc.2003-031641.
- Fitzgerald S.P., Falhammar H. Redefinition of successful treatment of patients with hypothyroidism. Is TSH the best biomarker of euthyroidism? Front. Endocrinol. 2022. 13. 920854. doi: 10.1136/bmj.l2006.
- Bekkering G., Agoritsas T., Lytvyn L., Heen A.F., Feller M., Moutzouri E. et al. Thyroid hormones treatment for subclinical hypothyroidism: a clinical practice guideline. BMJ. 2019. 365. l2006. doi: 10.1016/S0021-9258(18)87324-0.
- Calsolaro V., Niccolai F., Pasqualetti G., Calabrese A.M., Polini A., Okoye C. et al. Overt and subclinical hypothyroidism in the elderly: When to treat? Front. Endocrinol. 2019. 10. 177. doi: 10.1055/a-1022-9916.

/114.jpg)