Международный эндокринологический журнал Том 19, №8, 2023
Вернуться к номеру
Огляд Всесвітнього конгресу з вивчення раку щитоподібної залози 2023 р. (WCTC-2023, Лондон): чи з’явилося світло в кінці тунелю для пацієнтів із занедбаним раком?
Авторы: Черенько С.М.
Д.м.н., професор, FEBS/DES, заслужений діяч науки і техніки України; національний делегат України в Європейському товаристві ендокринних хірургів (ESES); представник Американського товариства хірургії голови та шиї (AHNS) у Східній Європі; почесний представник України в Азійсько-Тихоокеанському товаристві тиреоїдних хірургів (APTS); керівник центру ендокринної хірургії міжнародної клініки CitiDoctor, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
У червні 2023 року відбувся черговий Всесвітній конгрес із вивчення тиреоїдного раку (WCTC), який проходив в Лондоні, Велика Британія. Отримавши унікальну нагоду безпосередньо взяти участь у цьому заході вищого ґатунку світової ендокринологічної науки, виступити з усними й постерними доповідями, з радістю поділюся своїми враженнями й думками.
Пандемія COVID-19, а потім варварська агресія РФ в Україні відкинули фахову спеціалізовану медичну спільноту нашої країни на декілька років як у зацікавленості «тонкими» медичними знаннями, так і в можливостях використання сучасних діагностичних і лікувальних технологій. Багато іноземних представництв заморозили свою діяльність, виникли перебої з поставками ліків і комплектуючих, деякі генетичні лабораторії припинили відбір проб через неможливість гарантувати логістику та інше.
Водночас у такій галузі ендокринології та ендокринної хірургії, як тиреоїдологія, яка стосується мільйонів українців і сотень лікарів, ще більше посилився розрив між великою кількістю виявлених (найчастіше незагрозливих) структурних і функціональних порушень щитоподібної залози (ЩЗ), які стають причиною поглиблення тривожних станів пацієнтів, особливо при наполегливому «занепокоєнні» лікарів, і невеликою часткою занедбаних випадків переважно онкологічних тиреоїдних захворювань, які становлять реальну загрозу для здоров’я і життя хворих. Саме на лікування занедбаних випадків раку всіх ендокринних залоз був спрямований останній конгрес Європейського товариства ендокринних хірургів (ESES-2023, Mainz), а Всесвітній конгрес із тиреоїдного раку (WCTC-23) зосередився переважно на прогностично несприятливих формах раку щитоподібної залози, які й становлять основну групу летальності при цій нозології.
Конгрес у Лондоні став певною мірою знаковим та епохальним, адже він підвів риску під 30-річним періодом імплементації генетичних досягнень у практику тиреоїдної онкології. Про це доповів легендарний James Fagin з Нью-Йорка, який є одним з найбільш відомих фахівців у галузі досліджень патогенезу тиреоїдного раку. Так, у 1993 році було відкрито зародкову мутацію Ret-протоонкогена як генетичну причину сімейного медулярного раку — компонента синдрому MEN 2a. Це дало змогу розпочати не тільки сімейний генетичний скринінг хвороби, але й роботи з пошуку специфічних молекулярних інгібіторів канцерогенезу з когорти тирозинкіназ, що завершились уже через 10 років тріумфальною появою першого препарату для лікування метастатичного медулярного раку — вандетанібу.
Так само до 1993 року не було жодних терапевтичних можливостей для лікування радіойод-нечутливого диференційованого раку щитоподібної залози. У 1993 році після припущення, що канцерогенез пов’язаний з ангіогенезом, було синтезовано моноклональне антитіло проти VEGF-рецептора, який запускає каскад подій, залучених до ангіогенезу. Продовженням цього напрямку стала розробка мультикіназних інгібіторів, спрямованих на блокаду KDR і VEGF, яка завершилася синтезом дуже ефективних препаратів мотезанібу і ленватинібу; останній зараз схвалений FDA і демонструє дуже обнадійливі результати в редиференціюванні несприятливих форм папілярного і фолікулярного тиреоїдного раку (65 % RR). Так само революційними виявилися дослідження іншого патологічного молекулярного шляху канцерогенезу — MAPK, який пов’язаний із провідною роллю мутації BRAFV600E, що стає тригером не тільки для низькодиференційованого раку щитоподібної залози, але й для абсолютно безнадійного досі анапластичного раку. Після відкриття суттєвої поширеності цієї мутації в анапластичних карциномах з’явився реальний шанс продовжити життя й зробити операбельними випадки анапластичного раку в половини пацієнтів шляхом використання нових препаратів, націлених на цю мутацію, — добрафенібу і траметинібу (особливо в комбінації один з одним).
До 1993 року селекція тиреоїдних вузлів на потенційно злоякісні й доброякісні робилась переважно на підставі сцинтиграфії щитоподібної залози з радіоактивним йодом чи технецієм. Згодом була впроваджена система Bethesda для опису знахідок у пункційному матеріалі тиреоїдних вузлів, яка в цьому році зазнала третьої редакції, що вже реально враховує генетичні особливості різновидів раку і спрямовує на поглиблене вивчення молекулярних особливостей пухлин. Так, остання робота міжнародної групи авторів з генетичного профілю 50 734 тиреоїдних пухлин, кваліфікованих за системою Bethesda як ІІІ–VI класи, відкриває реальний шлях до персоніфікованого лікування завдяки можливості надійного виключення несприятливих за своїм прогнозом новоутворень. Так, випереджаючи свій час, у 1993 році японські вчені на чолі з Y. Ito та A. Miyauchi розпочали безпрецедентний експеримент із заміною невідкладної операції при виявленому маленькому диференційованому раку щитоподібної залози на тривале активне спостереження за пухлиною. На сьогодні вже тисячі пацієнтів знаходяться під таким наглядом, а остання робота A. Miyauchi (2023) свідчить, що у 80 % пацієнтів за 30 років спостереження пухлини не набули ознак агресивної поведінки. Сучасні молекулярно-генетичні можливості можуть ще більш обґрунтовано селекціонувати хворих з маленьким папілярним раком до тривалого спостереження без операції, адже саме маленьким (1–2 см) пухлинам «завдячує» тиреоїдний рак своїм 2,5-кратним зростанням за останні 30 років. І останнім аспектом впливу генетичних досліджень на лікування тиреоїдного раку Джеймс Фагін називає зменшення очікувань щодо ефективності застосування радіоактивного йоду в лікуванні пацієнтів з диференційованими карциномами щитоподібної залози. Адже більшість пухлин, які потребують ад’ювантного радіо–ізотопного лікування, належать до карцином з відомими мутаціями (BRAF, TERT, p53, PI3K та інших шляхів), а вони, у свою чергу, роблять тиреоїдні клітини такими, що втрачають здатність до накопичення радіоактивного йоду. Тому робиться висновок про необхідність розробки й застосування редиференціюючих препаратів і призначення радіойоду тільки за об’єктивними показаннями (принаймні лише для групи високого і проміжного ризику за рекомендаціями Американської тиреоїдної асоціації, 2015 р.), скорочення випадків по–вторного застосування ізотопів йоду після відсутності накопичення радіофармпрепарату.
Крім зазначених вище кардинальних відкриттів і розробок, за останні 2 роки відбулися знакові події щодо номенклатури й класифікації пухлинних захворювань щитоподібної залози: насамперед це нова (шоста) редакція Класифікації тиреоїдних неоплазій Всесвітньої організації охорони здоров’я (ВООЗ) (WHO 2022 Classification of Thyroid neoplasms [1, 2]); а також чергова (третя) редакція системи Bethesda щодо визначення результатів цитологічного дослідження пунктатів щитоподібної залози (The 2023 Bethesda System for Reporting Thyroid Cytopathology [3]), які потребують глибокого осмислення й оцінки із зацікавленими лікарями відповідних напрямків — взірець подібних обговорень був продемонстрований на конгресі. Іншими досягненнями, які мали знайти своє вагоме місце в дискусіях на WCTC-2023, стали оновлені результати клінічних досліджень таргетних протипухлинних препаратів і препаратів для імунотерапії, які випробовувались у лікуванні занедбаного раку щитоподібної залози, а також офіційний перелік дозволених (FDA Сполучених Штатів Америки) для використання препаратів цих груп у різних клінічних ситуаціях і різних вікових групах.
Для узагальнення найсучасніших відомостей щодо генетичних передумов, діагностики, стратифікації на групи ризику і таргетної терапії, хірургічного, терапевтичного, радіологічного лікування потенційно летальних форм раку щитоподібної залози організаторами WCTC були залучені провідні генетики, ендокринологи, хірурги, радіологи, патоморфологи, хіміотерапевти з усього світу: від США і Канади до Європи, Японії, Австралії, Китаю, Бразилії, Індії тощо, які формували групи експертів для обговорення різноманітних клінічних випадків після кожного з пленарних засідань.
Основні напрямки роботи WCTC-23 можна згрупувати в такі розділи: «Нові технології в тиреоїдній хірургії та особливості хірургічного лікування тиреоїдного раку», «Молекулярно-генетичні досягнення в розумінні розвитку й прогресування тиреоїдних пухлин та їх вплив на діагностику, прогностичну оцінку та лікування раку щитоподібної залози», «Медулярний рак щитоподібної залози», «Рак щитоподібної залози у дітей», «Гюртле-клітинна тиреоїдна карцинома», «Післяопераційне ведення пацієнтів з тиреоїдним раком» та деякі інші.
Оскільки питання класифікації та номенклатури пухлин мають першочергове значення для правильного формулювання діагнозу й відповідних клінічних рішень, почнемо з огляду новинок шостої редакції Класифікації тиреоїдних пухлин ВООЗ 2022 р.
Хоча загальна структура нової класифікації тиреоїдних пухлин і зберігає класичний патологічний стиль — розподіл на доброякісні, неоплазми низького ризику і злоякісні пухлини з відповідною стратифікацією на високодиференційовані, high-grade (зниженого диференціювання), низькодиференційовані й анапластичні (недиференційовані) карциноми з відповідними патоморфологічними критеріями для кожної групи, але в текстовому супроводі надається детальна інформація щодо генетичного підґрунтя такого розподілу і стає очевидним, що саме провідна роль тієї чи іншої мутації генів, залучених до тиреоїдного карциногенезу, буде головним критерієм подальших модифікацій номенклатури захворювань щитоподібної залози.
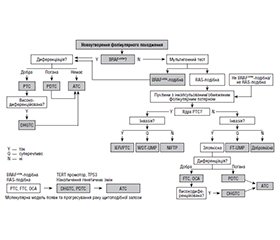
Так, у принциповій схемі (рис. 1) наведено основні типи доброякісних і умовно-доброякісних (з непевним потенціалом малігнізації) пухлин, а групу злоякісних пухлин доповнено новим підтипом низькодиференційованого раку — так званим high-grade диференційованим раком, який зберігає фолікулярну, фолікулярно-папілярну або солідну структуру паренхіми, хоча має застережливі ознаки некрозів і мітозів (понад 5 на 2 мм2) з інвазивними характеристиками. «Традиційний» низькодиференційований рак натомість втрачає типові для папілярного чи фолікулярного раку структурні характеристики та ядерні ознаки.
При цьому класичні папілярні, фолікулярні, оксифільно-клітинні карциноми будуть мати сприятливий прогноз, високоступеневі (high-grade) і низькодиференційовані пухлини — проміжний, а анапластичні пухлини — поганий прогноз щодо тривалого виживання (рис. 2).
Дослідники, які враховують усі зауваження генетиків при обговоренні нової редакції класифікації тиреоїдних пухлин, пропонують одразу розподіляти всі тиреоїдні неоплазії відповідно до основних категорій провідних мутацій карциногенезу. Це було всебічно висвітлено на WCTC-2023. Так, C. Jung і співавт. [2] підкреслили, що розподіл пухлин з фолікулярного епітелію доцільно робити не тільки за ступенем диференціювання, але й за основним типом мутації, що призвела до розвитку раку, а саме мутації типу BRAFV600Е або мутації типу RAS. Цей принциповий розподіл дозволяє зазирнути за обрій і передбачити поведінку пухлини в майбутньому, що, безумовно, впливатиме на характер і обсяг лікування. Адже пухлини з BRAFV600Е формуватимуть групу папілярного раку (як класичного його варіанта, так і нетипових варіантів з гіршим прогнозом) з переважно лімфогенним метастазуванням, можливим зниженням диференціації через низькодиференційований рак аж до анапластичного. Натомість пухлини з пулу RAS мутацій формують дуже різнорідну групу фолікулярних пухлин: від добро–якісних фолікулярних аденом до фолікулярних карцином, низькодиференційованих тиреоїдних карцином, анапластичного раку або (за наявності ядерних ознак, притаманних папілярним карциномам) фолікулярних варіантів папілярного раку (інкапсульованих, у тому числі NIFTP, або інвазивних). Причому в групі класичних фолікулярних карцином окремо виділяється (вперше!) оксифільно-клітинна карцинома (раніше її називали Гюртле-клітинною карциномою). У кожній гілці цього класифікаційного дерева йде розподіл пухлин за ступенем диференціювання (високе (well), низьке (poor) та анпластичні карциноми). Уперше щодо ступеня зниження диференціювання додається нове проміжне поняття high-grade, яке віддзеркалює зниження диференціювання за наявністю мітозів і некрозів, але зберігає певну фолікулярну/папілярну морфологічну структуру карциноми.
Такий ускладнений (на перший погляд) розподіл пухлин щитоподібної залози фолікулярного походження знаходить пояснення, коли ми розглянемо можливості ад’ювантної та неоад’ювантної терапії занедбаних тиреоїдних карцином. Адже донедавна лікарі задовольнялися цілком сприятливими результатами хірургічного і радіологічного лікування високодиференційованих тиреоїдних карцином і складали руки, коли стикалися з низькодиференційованими й анапластичними раками, коли радикальна хірургія часом є неможливою вже під час встановлення діагнозу, а здатність до накопичення радіоактивного йоду відсутня або різко знижена. Остання група пацієнтів і формувала когорту хворих, приречених на хворобоспецифічну летальність. Зараз, вочевидь, ми стоїмо на порозі нової ери комбінованого лікування і можемо сказати, що бачимо світло в кінці тунелю, який нещодавно здавався безвихідним. Адже таргетні (спрямовані на конкретний тип мутації — драйвера раку) препарати, імунотерапевтичні препарати та препарати, що сприяють редиференціації пухлин, дають можливість суттєвого подовження життя в більшої частини таких пацієнтів.
Стандартна хірургічна операція в пацієнтів з раком щитоподібної залози обговорювалась також у рамках конгресу, але суттєвих новинок не спостерігалось. Подальшого розвитку набули технології інтраопераційного нейромоніторингу гортанних нервів і використання флуоресценції прищитоподібних залоз для їх пошуку і більш гарантованого збереження. Велика оглядова лекція відомого німецького тиреоїдного хірурга з провідної клініки університету імені Мартіна Лютера — Ріка Шнейдера (Rick Schneider) переконливо довела переваги використання нейромоніторингу для зменшення частоти тимчасових і постійних парезів гортані, а також доцільність доповнення періодичного використання стимулів подразнення нижніх і верхніх гортанних нервів (IONM) подовженим моніторингом блукаючого нерва (Continuous Intraoperative Nerve Monitoring — COINM), враховуючи розтягнення поворотного гортанного нерва як основний механізм його травми на противагу прямому ушкодженню нерва. Цікавими є відомості щодо частоти використання електронейромоніторингу гортанних нервів у тиреоїдній хірургії в різних країнах: 2/3 — у США, 91 % — у Євросоюзі, 59 % — у Великій Британії та 98 % — у Німеччині. При цьому заявлена частота всіх типів ушкоджень гортанних нервів у багатоцентрових дослідженнях і систематизованій європейській базі даних Eurocrine дорівнює 4,9 % у Британії, 3,6 % — у Німеччині при доброякісних захворюваннях, 5,7–6,8 % — у США, 0,9–3,1 % — у Західній Європі (розмах показників у всіх випадках відбиває вірогідне зменшення частоти парезу гортані в разі використання нейромоніторингу). Безперервний (подовжений) нейромоніторинг (з розміщенням електроду на n. vagus) користується меншою популярністю, ніж періодичний імпульсний (подразнення самих гортанних нервів у рані) — 82 % проти 17 % у Німеччині. Такі великі за обсягом (багато десятків тисяч пацієнтів в аналізі) дослідження зі статистично вірогідними результатами мають покласти кінець суперечкам щодо корисності нейромоніторингу в тиреоїдній і паратиреоїдній хірургії.
Іншим напрямком зменшення рівня ускладнень у тиреоїдній хірургії є використання методики спонтанної чи ампліфікованої (внутрішньовенним введенням розчину зеленого індоціану) флуоресценції прищитоподібних залоз. Ця технологія більш нова (менше за 10 років), ніж нейромоніторинг, і ще не знайшла стільки ж прибічників. Частота її використання також значно менша — не більше ніж 5–10 % хірургів. За даними ключового запрошеного лектора — французького дослідника Fares Benmiloud з Марселя, методика вірогідно має більшу користь для молодих хірургів і не приносить додаткового зиску досвідченим хірургам (понад 5 років досвіду). Багатоцентрові дослідження показали більшу кількість виявлених прищитоподібних залоз під час операцій з використанням детекції флуоресцентного випромінювання порівняно з «голим оком», вірогідно меншу частку пацієнтів з післяопераційною гіпокальціємією на перший післяопераційний день після тотальної тиреоїдектомії. Водночас різниця в частоті зниження паратиреоїдної функції (відсоток пацієнтів зі зниженим рівнем паратгормону) несуттєва, за винятком підгрупи хворих, яким тиреоїдектомію доповнювали центральною дисекцією шиї.
Набагато більше уваги на конгресі приділялось хірургічному лікуванню занедбаних випадків тиреоїдного раку. Адже саме ці випадки карцином стають причиною смерті пацієнтів у 95 % випадків. Стрижньовою ідеєю хірургії раку щитоподібної залози залишається проведення R0-резекції пухлини (тобто видалення раку в межах здорових тканин) і водночас збереження високої якості життя, враховуючи можливість досягнення тривалого виживання навіть у випадках місцевопоширених і метастатичних тиреоїдних карцином. Якщо в питанні збереження якості життя на першому місці стоять особливості техніки операції зі збереженням або реконструкцією гортанних нервів, використання інтраопераційного нейромоніторингу і технологій візуалізації та щадного ставлення до прищитоподібних залоз, то саме глобальне питання можливості виконання радикальної операції з видалення місцевопоширеної інвазивної пухлини завжди впиралося в неможливість виконання операції через проростання життєво важливих органів і структур шиї вже під час діагностування агресивних випадків раку. Це стосувалось насамперед агресивного диференційованого раку, низькодиференційованого та анапластичного раку і медулярного місцевопоширеного раку щитоподібної залози.
Новим словом у подоланні цих хірургічних перешкод стала низка доповідей на конгресі, які демонстрували можливості сучасних таргетних препаратів у трансформації первинно неоперабельних пухлин у відносно операбельні шляхом проведення 3–6-місячних курсів неоад’ювантної терапії.
Вражаючі знімки комп’ютерної томографії та магнітно-резонансної томографії до і після такого лікування перевернули уявлення щодо фатальності більшості випадків занедбаного тиреоїдного раку (рис. 4).
Перелік препаратів для застосування як неоад’ювантної терапії вже вийшов за рамки тільки клінічних випробувань, багато з них офіційно схвалені FDA Сполучених Штатів Америки. Крім уже відомих, переважно антиангіогенних, препаратів для лікування метастатичного і місцевопоширеного диференційованого раку (сорафеніб) і медулярного раку (вандетаніб, кабозантиніб) з’явилися препарати, спрямовані на конкретні молекулярно-генетичні шляхи канцерогенезу.
Так, для подолання йод-резистентності та редиференціювання агресивних форм папілярного і фолікулярного раку запропонований ленватиніб з 65 % позитивної реакції на терапію. Для неоад’ювантної терапії BRAF-мутованого анапластичного раку з успіхом (RR = 56 %) використовується комбінація добрафенібу і траметинібу. Для диференційованих пухлин, що несуть злиття генів NTRK, пропонується ларотректиніб (RR = 86 %), а для пухлин, що несуть RET-fusion гени, — селперкатиніб і пралсетиніб (RR = 79 % і RR = 89 %, що є дуже високими показниками відповіді на лікування). Останні два препарати з трохи меншою ефективністю (71–73 % RR) допомагають подолати неоперабельність також і для спорадичних форм медулярного раку щитоподібної залози, які несуть соматичні мутації RET-протоонкогену (таке трапляється в 60–65 % випадків). Отже, після 3–6-місячного курсу терапії в більшості пацієнтів з’являється шанс бути радикально прооперованими з приводу місцевопоширених форм тиреоїдного раку, що, у свою чергу, подовжує тривалість виживання до 3–5–10 років залежно від форми пухлини.
Питання тривалої виживаності було ключовим в оцінці сучасних підходів до лікування диференційованого раку щитоподібної залози в пацієнтів дитячого віку.
Так, найбільш авторитетний у світі онкологічний центр MD Anderson Cancer Center подав своє бачення сучасного лікування раку щитоподібної залози в дітей, яке ґрунтується на 60-річних спостереженнях за пролікованими пацієнтами, нових даних щодо генетичних особливостей канцерогенезу в дітей, а також нових можливостях таргетної терапії. Головний меседж доповіді Steven Wagnespack — «діти — це не малі дорослі» і «головне — не нашкодити», тому що диференційований тиреоїдний рак у дітей є більш агресивним у питанні розміру, частоти місцевих і віддалених метастазів, але в той же час є прогностично в десять разів більш сприятливим (55 років проти 5 років в оцінці хворобоспецифічного виживання — DSS). Тобто важко поліпшити і так чудові віддалені результати лікування!
Водночас багато спостережень щодо розвитку вторинних злоякісних пухлин після опромінення шиї, повторних курсів радіойодтерапії та фіброзу легень після наполегливого радіологічного лікування метастатичного тиреоїдного раку мають зараз стримувати лікарів від надмірного застосування радіоактивного йоду і стимулювати до пошуку можливостей використання таргетної антикіназної терапії, деякі препарати якої вже дозволені для дітей від 6 років. Молекулярно-генетичні дослідження в цій віковій категорії пацієнтів вказують на переважання злиття генів (переважно RET/NTRK fusion) над окремими тригерними мутаціями, особливо серед пухлин з віддаленими метастазами, серед яких на частку RET/NTRK fusion припадає 81 %, а BRAF — тільки 12 %. Ці особливості можуть допомогти обрати вірний таргетний препарат для занедбаних прогресуючих випадків.
Більш активне хірургічне ставлення до підозрілих тиреоїдних вузлів у дітей (враховуючи більшу частоту раку серед них і його більшу агресивність) знайшло своє відображення і в новій редакції системи Bethesda щодо визначення результатів цитологічного дослідження пунктатів щитоподібної залози (The 2023 Bethesda System for Reporting Thyroid Cytopathology), де вперше цитологічна діагностика тиреоїдних вузлів і відповідний для кожної з шести категорій результатів ризик злоякісності зазначені окремо для педіатричної групи пацієнтів (табл. 1).
Можна побачити, що порівняно із загальними рекомендаціями (для дорослих) для кожної з діагностичних категорій системи Bethesda-2023 для дітей менш актуальне молекулярно-генетичне дослідження пунктатів, зате більшим є ризик злоякісності та, відповідно, є наполегливішими рекомендації щодо хірургічного лікування (табл. 2).
Окреме місце в дискусіях на конгресі посіли питання онкоцитоклітинного раку щитоподібної залози, який тільки в останній редакції класифікації тиреоїдних пухлин ВООЗ 2022 року набув вірної назви після сторічної плутанини в термінології (Гюртле-клітинна, ашкеназі-клітинна, оксіфільно-клітинна пухлина). Цей різновид пухлини з фолікулярного епітелію щитоподібної залози, хоч і не є частим варіантом (4 % всіх раків), заслуговує на особливу увагу через високу ймовірність (25 %) віддалених метастазів і знижену здатність до накопичення радіоактивного йоду. Третина всіх онкоцитарних вузлів є злоякісними. Фолікулярні онкоцитарні раки з широкою інвазією мають найгірший прогноз серед усіх фолікулярних пухлин. Найвищу ефективність у візуальній діагностиці демонструє ПЕТ-КТ з 18F-флуородезоксиглюкозою. Пункційна біопсія та сонографічна діагностика мають малу інформативність. У лікуванні прогностично важливим є повне видалення пухлини. Лікування радіоактивним йодом не покращує виживання, зате застосування нових таргетних препаратів (ленватиніб, сорафеніб) демонструє обнадійливі результати в клінічних випробуваннях.
Організатори конгресу не могли оминути й таку суперечливу тему, як високочастотна радіоабляція (та інші малоінвазивні технології деструкції пухлин і вузлів, які проводяться під сонографічним контролем) доброякісних і злоякісних утворень щитоподібної залози, яка за останні роки набула широкого вжитку й потребує чіткого визначення показань і протипоказань. Міжнародний (за участю восьми найбільших профільних асоціацій світу) принциповий консенсус із цього питання був прийнятий у 2022 році [4].
Не піддаючи сумніву численні повідомлення з усього світу щодо успішної деструкції доброякісних і злоякісних вогнищевих уражень щитоподібної залози та лімфовузлів шиї, автори консенсусу застерігають від поширеного й безконтрольного використання цих технологій у практиці лікування тиреоїдних новоутворень, за винятком гіперфункціональних тиреоїдних вузлів (токсичних аденом), коли ризик малігнізації мінімальний. Натомість в інших випадках методика малоінвазійної деструкції може бути застосована тільки при неможливості виконати хірургічну операцію (через тяжкість загального стану, високі ризики тощо) або при відмові пацієнта і після обговорення випадку на мультидисциплінарній онкологічній комісії в потужних науково-дослідних клінічних закладах.
Останні сесії конгресу були присвячені співпраці WCTC і NCCN (National Comprehensive Cancer Network) — найвідомішої організації (США) з розробки настанов з лікування всіх різновидів раку, якими користуються всі фахівці світу. У цьому році за участю провідних вчених, залучених до WCTC-2023, розроблено стратифікований підхід до рекомендацій з лікування раку щитоподібної залози (NCCN 4.2023 Thyroid Cancer), який врахував економічні й соціальні можливості країн з різним рівнем розвитку. Такі рекомендації (у їх розробці безпосередню участь уперше взяв фахівець з України — проф. С.М. Черенько) сприятимуть кращій імплементації нових досягнень у діагностиці й лікуванні тиреоїдного раку, визначать найголовніші заходи та такі, які можна замінити альтернативними методами.
Загалом Всесвітній конгрес із тиреоїдного раку (WCTC-2023) у Лондоні продемонстрував найвищий рівень залучення міжнародних фахівців різного профілю, високу зацікавленість аудиторії з усіх куточків світу, показав справжні досягнення сучасної медичної науки й горизонти наших очікувань у лікуванні раку щитоподібної залози.
Хочеться вірити, що для українських колег ця нова інформація буде корисною та спонукатиме до подальшого професійного вдосконалення попри всі виклики нашого сьогодення.
Отримано/Received 07.10.2023
Рецензовано/Revised 17.10.2023
Прийнято до друку/Accepted 25.10.2023
Список литературы
- Juhlin C., Mete O., Baloch Z.W. The 2022 WHO classification of thyroid tumors: novel concepts in nomenclature and grading. Endocr. Relat. Cancer. 2022 Dec 22. 30(2). e220293. doi: 10.1530/ERC-22-0293. PMID: 36445235.
- Jung C.K., Bychkov A., Kakudo K. Update from the 2022 World Health Organization Classification of Thyroid Tumors: A Standardized Diagnostic Approach. Endocrinol. Metab. (Seoul). 2022 Oct. 37(5). 703-718. doi: 10.3803/EnM.2022.1553. Epub 2022 Oct 4. PMID: 36193717; PMCID: PMC9633223.
- Ali S.Z., Baloch Z.W., Cochand-Priollet B., Schmitt F.C., Vielh P., VanderLaan P.A. The 2023 Bethesda System for Reporting Thyroid Cytopathology. Thyroid. 2023 Sep. 33(9). 1039-1044. doi: 10.1089/thy.2023.0141. Epub 2023 Jul 8. PMID: 37427847.
- Orloff L.A., Noel J.E., Stack B.C. Jr, Russell M.D., Angelos P., Baek J.H., Brumund K.T. et al. Radiofrequency ablation and related ultrasound-guided ablation technologies for treatment of benign and malignant thyroid disease: An international multidisciplinary consensus statement of the American Head and Neck Society Endocrine Surgery Section with the Asia Pacific Society of Thyroid Surgery, Associazione Medici Endocrinologi, British Association of Endocrine and Thyroid Surgeons, European Thyroid Association, Italian Society of Endocrine Surgery Units, Korean Society of Thyroid Radiology, Latin American Thyroid Society, and Thyroid Nodules Therapies Association. Head Neck. 2022 Mar. 44(3). 633-660. doi: 10.1002/hed.26960. Epub 2021 Dec 23. PMID: 34939714.

/8.jpg)
/9.jpg)
/10.jpg)
/11.jpg)
/12.jpg)