Международный эндокринологический журнал Том 21, №2, 2025
Вернуться к номеру
Рівні запальних, ангіогенних та стресових біомаркерів у плазмі донорів залежно від титрів anti-SARS-CoV-2 IgG
Авторы: D.I. Krenytska (1), V.L. Karbovskyy (1), Ludovico Abenavoli (2), T.M. Falalyeyeva (1), Giuseppe Guido Maria Scarlata (2), N.G. Raksha (1), T.B. Vovk (1), L.I. Kot (1), O.M. Savchuk (1), Maria Luisa Gambardella (2), O.I. Kovalchuk (1), V.I. Pankiv (3), L.I. Ostapchenko (1)
(1) - Taras Shevchenko National University of Kyiv, Kyiv, Ukraine
(2) - Magna Græcia University, Catanzaro, Italy
(3) - Ukrainian Scientific and Practical Centre of Endocrine Surgery, Transplantation of Endocrine Organs and Tissues of MHU, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
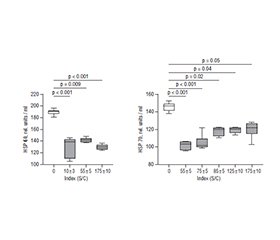
Актуальність. Коронавірусна хвороба-2019 (COVID-19), спричинена інфекцією тяжкого гострого респіраторного синдрому Coronavirus-2 (SARS-CoV-2), призвела до значного поширення хвороби та глобальних викликів охороні здоров’я. Хоча гостра фаза інфекції була ретельно вивчена, довгострокові наслідки, особливо в осіб, які одужали, залишаються нез’ясованими. Ускладнення SARS-CoV-2 включають окремі симптоми та системні розлади, зокрема стійке запалення, ендотеліальну дисфункцію та порушення імунної регуляції, які часто тривають місяцями. Серед ключових факторів, що сприяють виникненню цих станів, прозапальні цитокіни, фактори росту, що беруть участь у ангіогенезі, протеїни, викликані гіпоксією та пов’язані зі стресом, які відіграють значну роль у відновленні тканин і модуляції імунної відповіді. Мета: оцінити ступінь запалення, визначити рівні проангіогенних факторів, клітинного маркера гіпоксії HIF-1α та білків теплового шоку, як-от HSP60 і HSP70, у плазмі здорових донорів, які одужали від COVID-19, з особливим акцентом на зв’язок між рівнями цих біомаркерів і титрами IgG проти SARS-CoV-2. Матеріали та методи. У цьому дослідженні брали участь донори віком від 25 до 45 років, які одужали від COVID-19 принаймні за 3–6 місяців до початку дослідження. Усі пацієнти були розділені на групи за титрами анти-SARS-CoV-2 IgG. Рівні запального TNF-α, фактора транскрипції NF-κB, ангіогенних факторів VEGF, PDGF і FGF-2, фактора гіпоксії HIF-1α та білків теплового шоку вимірювали за допомогою імуноферментного аналізу. Групові відмінності аналізували за допомогою ANOVA з тестом Тьюкі або Краскела — Уолліса з тестом Данна, результати подавали як медіану та IQR, зі значущістю при p ≤ 0,05. Результати. Дослідження виявило значні відмінності в рівнях аналізованих показників у плазмі серед груп донорів із різними титрами IgG проти SARS-CoV-2. Спостерігалося збільшення прозапальних маркерів, як-от TNF-α та NF-κB, у плазмі донорів із вищими титрами IgG проти SARS-CoV-2. Рівні ангіогенних VEGF, PDGF і FGF-2 демонстрували чіткі закономірності, причому рівні VEGF загалом були знижені, за винятком групи донорів з титрами 95 ± 5 і 125 ± 10 Index (S/C), де вони значно підвищувалися. Уміст PDGF і FGF-2 був вірогідно вищим в групах донорів з титрами 95 ± 5 і 175 ± 10 Index (S/C). Рівні HIF-1α також значно підвищилися в плазмі донорів із титрами IgG проти SARS-CoV-2 75 ± 5 і 175 ± 10 Index (S/C) порівняно з донорами без IgG проти SARS-CoV-2. Навпаки, рівні білків теплового шоку HSP60 і HSP70 були значно знижені в плазмі всіх груп донорів порівняно з контрольною групою, що могло вказувати на можливі аномалії в механізмах відповіді на стрес після COVID-19. Висновки. Отримані результати свідчать про те, що тривала імунна активація, запалення та шляхи, пов’язані з ангіогенезом, відіграють вирішальну роль у патогенезі ускладнень після COVID-19, що підкреслює необхідність терапевтичних стратегій для лікування хронічного запалення, ендотеліальної дисфункції та порушення відновлення тканин.
Background. Coronavirus disease 2019 (COVID-19), caused by the severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection, has led to widespread illness and global health challenges. While the acute phase of the infection has been extensively studied, the long-term effects, particularly in individuals who have recovered, remain unclear. Post-acute complications of SARS-CoV-2 involves prolonged symptoms and systemic disorders, including persistent inflammation, endothelial dysfunction, and immune dysregulation, which often last for months. Among the key factors contributing to these conditions, there are pro-inflammatory cytokines, growth factors involved in angiogenesis, hypoxia-inducible and stress-related proteins, which play a significant role in tissue repair and immune response modulation. The research aimed to evaluate the degree of inflammation, to determine the levels of pro-angiogenic factors, сellular hypoxia marker HIF-1α, and heat shock proteins, such as HSP60 and HSP70, in plasma of healthy donors who have recovered from COVID-19, with a particular focus on the relationship between the levels of these biomarkers and anti-SARS-CoV-2 IgG titers. Materials and methods. This research involved donors between the ages of 25 and 45 years, who had recovered from COVID-19 at least 3 to 6 months prior to the beginning of the study. All patients were divided into groups based on their anti-SARS-CoV-2 IgG titers. The plasma levels of inflammatory TNF-α, transcription factor NF-κB, angiogenic factors VEGF, PDGF and FGF-2, hypoxic factor HIF-1α, and heat shock proteins were measured by enzyme-linked immunosorbent assay. Group differences were analyzed using ANOVA with Tukey’s test or Kruskal-Wallis with Dunn’s test, presenting results as median and interquartile range, with significance at p ≤ 0.05. Results. The study found significant differences in the plasma levels of the analyzed parameters among donor groups with varying anti-SARS-CoV-2 IgG titers. There was an increase in pro-inflammatory markers, such as TNF-α and NF-κB, in plasma of donors with higher anti-SARS-CoV-2 IgG titers. The levels of angiogenic VEGF, PDGF, and FGF-2 showed distinct patterns, with VEGF levels generally reduced, except in the group of donors with titers of 95 ± 5 and 125 ± 10 Index (S/C), where they significantly increased. PDGF and FGF-2 levels were notably higher in groups of donors with titers of 95 ± 5 and 175 ± 10 Index (S/C). HIF-1α levels also increased significantly in plasma of donors with anti-SARS-CoV-2 IgG titers of 75 ± 5 and 175 ± 10 Index (S/C) compared to those without anti-SARS-CoV-2 IgG. In contrast, the levels of heat shock proteins HSP60 and HSP70 were significantly reduced in the plasma of all donor groups compared to the reference group, which could indicate possible abnormalities in the mechanisms of stress response after COVID-19. Conclusions. Our results suggest that prolonged immune activation, inflammation, and angiogenesis-related pathways play a crucial role in the pathogenesis of post-COVID-19 complications, underscoring the need for therapeutic strategies to address chronic inflammation, endothelial dysfunction, and impaired tissue recovery.
long-COVID-19; анти-SARS-CoV-2 IgG; запалення; ангіогенез; фактори росту
long COVID-19; anti-SARS-CoV-2 IgG; inflammation; angiogenesis; growth factors
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Davis HE, Assaf GS, McCorkell L, et al. Characterizing long COVID in an international cohort: 7 months of symptoms and their impact. EClinicalMedicine. 2021;38:101019. doi: 10.1016/j.eclinm.2021.101019.
- Mohan A, Iyer VA, Kumar D, Batra L, Dahiya P. Navi–gating the Post-COVID-19 Immunological Era: Understanding Long COVID-19 and Immune Response. Life. 2023;13(11):2121. https://doi.org/10.3390/life13112121.
- Pan Y, Jiang X, Yang L, et al. SARS-CoV-2-specific immune response in COVID-19 convalescent individuals. Signal Transduct Target Ther. 2021 Jul 7;6(1):256. doi: 10.1038/s41392-021-00686-1.
- Liu Y, Gu X, Li H, Zhang H, Xu J. Mechanisms of long COVID: An updated review. Chin Med J Pulm Crit Care Med. 2023 Dec 6;1(4):231-240. doi: 10.1016/j.pccm.2023.10.003. PMID: 39171285; PMCID: PMC11332859.
- Matviichuk A, Yerokhovych V, Zemskov S, et al. Unveiling Risk Factors for Post-COVID-19 Syndrome Development in People with Type 2 Diabetes. Front. Endocrinol. 2024;15:1459171. doi: 10.3389/fendo.2024.1459171.
- Mehandru S, Merad M. Pathological sequelae of long-haul COVID. Nat. Immunol. 2022;23:194202. doi: 10.1038/s41590-021-01104-y.
- Matviichuk A, Yerokhovych V, Ilkiv Y, et al. HbA1c and leukocyte mtDNA levels as major factors associated with post-COVID-19 syndrome in type 2 diabetes patients. Sci Rep. 2024;14:25533. https://doi.org/10.1038/s41598-024-77496-2.
- Ewing A, Salamon S, Pretorius E, Joffe D, Fox G, Bilodeau S, Bar-Yam Y. Review of organ damage from COVID and Long COVID: a disease with a spectrum of pathology. Medical Review. 2024. https://doi.org/10.1515/mr-2024-0030.
- Parotto M, Gyöngyösi M, Howe K, et al. Post-acute sequelae of COVID-19: understanding and addressing the burden of multi-system manifestations. Lancet Respir Med. 2023;11:739-754. https://doi.org/–10.1016/S2213-2600(23)00239-4.
- Bonetti TCS, Latini FRM, Invitti AL, Fonseca MCM, Scorza FA, Saldanha MG, Bellucco FT, Bacarov NBS, Soane MM, Girão MJBC. Antibody indexes in COVID-19 convalescent plasma donors: Unanswered questions. Clinics (Sao Paulo). 2021 Aug 27;76:e2818. doi: 10.6061/clinics/2021/e2818.
- Yousefi Z, Taheri N, Dargahi M, Chaman R, Binesh E, Emamian MH, Jafari R. Long-Term Persistence of Anti-SARS-CоV-2 IgG Antibodies. Curr Microbiol. 2022 Feb 12;79(4):96. doi: 10.1007/s00284-022-02800-0.
- Jazbec K, Jež M, Žiberna K, et al. Simple prediction of COVID-19 convalescent plasma units with high levels of neutralization antibodies. Virol J. 2023 Mar 27;20(1):53. doi: 10.1186/s12985-023-02007-0.
- Póvoa da Costa F, Sarges KML, Silva RD, et al. Genetic, Clinical, Epidemiological, and Immunological Profiling of IgG Response Duration after SARS-CoV-2 Infection. Int J Mol Sci. 2024 Aug 10;25(16):8740. doi: 10.3390/ijms25168740.
- Levi R, Ubaldi L, Pozzi C, et al. The antibody response to SARS-CoV-2 infection persists over at least 8 months in symptomatic patients. Commun Med (Lond). 2021;1(1):32. doi: 10.1038/s43856-021-00032-0.
- Chansaenroj J, Yorsaeng R, Posuwan N, et al. Long-term specific IgG response to SARS-CoV-2 nucleocapsid protein in recovered COVID-19 patients. Sci Rep. 2021 Dec 1;11(1):23216. doi: 10.1038/s41598-021-02659-4.
- Jesenak M, Brndiarova M, Urbancikova I, et al. Immune Parameters and COVID-19 Infection — Associations with Clinical Severity and Disease Prognosis. Front Cell Infect Microbiol. 2020 Jun 30;10:364. doi: 10.3389/fcimb.2020.00364.
- Zohar T, Alter G. Dissecting antibody-mediated protection against SARS-CoV-2. Nat Rev Immunol. 2020;20:392-394. https://doi.org/10.1038/s41577-020-0359-5.
- Jing X, Xu M, Song D, et al. Association between inflammatory cytokines and anti-SARS-CoV-2 antibodies in hospitalized patients with COVID-19. Immun Ageing. 2022 Mar 5;19(1):12. doi: 10.1186/s12979-022-00271-2. PMID: 35248063; PMCID: PMC8897556.
- Gupta A, Jayakumar MN, Saleh MA, Kannan M, Halwani R, Qaisar R, Ahmad F. SARS-CoV-2 infection-induced growth factors play differential roles in COVID-19 pathogenesis. Life Sci. 2022 Sep 1;304:120703. doi: 10.1016/j.lfs.2022.120703.
- Low RN, Low RJ, Akrami A. A review of cytokine-based pathophysiology of Long COVID symptoms. Front Med (Lausanne). 2023 Mar 31;10:1011936. doi: 10.3389/fmed.2023.1011936.
- Gudowska-Sawczuk M, Mroczko B. The Role of Nuclear Factor Kappa B (NF-κB) in Development and Treatment of COVID-19: Review. Int J Mol Sci. 2022 May 9;23(9):5283. doi: 10.3390/ijms23095283.
- Lange A, Lange J, Jaskuła E. Cytokine Overproduction and Immune System Dysregulation in alloHSCT and COVID-19 Patients. Front. Immunol. 2021;12:658896. doi: 10.3389/fimmu.2021.658896.
- Petakh P, Kobyliak N, Kamyshnyi A. Gut microbiota in patients with COVID-19 and type 2 diabetes: A culture-based me–thod. Front. Cell. Infect. Microbiol. 2023;13:1142578. doi: 10.3389/fcimb.2023.1142578. https://doi.org/10.3389/fcimb.2023.1142578.
- Iacobazzi D, Convertini P, Todisco S, Santarsiero A, Iacobaz–zi V, Infantino V. New Insights into NF-κB Signaling in Innate Immunity: Focus on Immunometabolic Crosstalks. Biology. 2023;12(6):776. https://doi.org/10.3390/biology12060776.
- Korotkyi O, Vovk A, Galenova T, et al. Effect of probiotic on serum cytokines and matrix metalloproteinases profiles during monoiodoacetate-induced osteoarthritis in rats. Minerva Biotecnologica 2019;31:68-73. doi: 10.23736/S1120-4826.19.02548-5.
- Hariharan A, Hakeem AR, Radhakrishnan S, Reddy MS, Rela M. The Role and Therapeutic Potential of NF-kappa-B Pathway in Severe COVID-19 Patients. Inflammopharmacology. 2021;29:91-100. doi: 10.1007/s10787-020-00773-9.
- Zhang JY, Whalley JP, Knight JC, Wicker LS, Todd JA, Ferreira RC. SARS-CoV-2 infection induces a long-lived pro-inflammatory transcriptional profile. Genome Med. 2023 Sep 12;15(1):69. doi: 10.1186/s13073-023-01227-x.
- Kesika P, Thangaleela S, Sisubalan N, Radha A, Sivamaru–thi BS, Chaiyasut C. The Role of the Nuclear Factor-Kappa B (NF-κB) Pathway in SARS-CoV-2 Infection. Pathogens. 2024;13(2):164. https://doi.org/10.3390/pathogens13020164.
- Gu J, Liu Q, Zhang J, Xu S. COVID-19 and trained immunity: the inflammatory burden of long COVID. Front Immunol. 2023 Nov 28;14:1294959. doi: 10.3389/fimmu.2023.1294959.
- Vuscan P, Kischkel B, Joosten LAB, Netea MG. Trained immunity: General and emerging concepts. Immunol Rev. 2024 May;323(1):164-185. doi: 10.1111/imr.13326.
- Hoepel W, Chen HJ, Geyer CE, et al. High titers and low fucosylation of early human anti-SARS-CoV-2 IgG promote inflammation by alveolar macrophages. Sci Transl Med. 2021 Jun 2;13(596):eabf8654. doi: 10.1126/scitranslmed.abf8654.
- Del Valle DM, Kim-Schulze S, Huang H-H, Beckmann ND, Nirenberg S, Wang B, et al. An inflammatory cytokine signature predicts COVID-19 severity and survival. Nat Med. 2020;26:1636-1643. doi: 10.1038/s41591-020-1051-9.
- Krenytska D, Kot L, Halenova T, Raksha N, Vovk T, Savchuk O, et al. Cytokine profile in patients with osteoarthritis after SARS-CoV-2 infection. Minerva Biotechnol Biomol Res. 2022;34:196-203. doi: 10.23736/S2724-542X.22.02943-1.
- Krenytska D, Rachkovska A, Karbovskyy V, et al. Cytokine profile depending on titers of anti-SARS-CoV-2 IgG in the blood plasma of healthy volunteers. Journal of Biological Research — Bollettino Della Società Italiana Di Biologia Sperimentale. 2023;96(2). https://doi.org/–10.4081/jbr.2023.11256.
- Tuharov Y, Krenytska D, Halenova T, et al. Plasma Levels of MMPs and TIMP-1 in Patients with Osteoarthritis After Recovery from COVID-19. Rev Recent Clin Trials. 2023;18(2):123-128. doi: 10.2174/–1574887118666230131141608.
- Halenova T, Rachkovska A, Krenytska D, et al. Abnormal proteolytic activity profile in plasma of blood donors according to anti-SARS-CoV-2 IgG titer. Journal of Biological Research — Bollettino Della Società Italiana Di Biologia Sperimentale. 2024. https://doi.org/10.4081/jbr.2024.12567.
- Vassiliou AG, Vrettou CS, Keskinidou C, Dimopoulou I, Kotanidou A, Orfanos SE. Endotheliopathy in Acute COVID-19 and Long COVID. International Journal of Molecular Sciences. 2023;24(9):8237. https://doi.org/10.3390/ijms24098237.
- Geindreau M, Bruchard M, Vegran F. Role of Cytokines and Chemokines in Angiogenesis in a Tumor Context. Cancers (Basel). 2022 May 16;14(10):2446. doi: 10.3390/cancers14102446.
- Krenytska D, Strubchevska K, Kozyk M, et al. Circula–ting levels of inflammatory cytokines and angiogenesis related growth factors in patients with osteoarthritis after COVID-19. Front. Med. 2023;10:1168487. doi: 10.3389/fmed.2023.1168487.
- Birnhuber A, Fließer E, Gorkiewicz G, et al. Between inflammation and thrombosis: endothelial cells in COVID-19. Eur Respir J. 2021 Sep 9;58(3):2100377. doi: 10.1183/13993003.00377-2021.
- Guo D, Wang Q, Li C, Wang Y, Chen X. VEGF stimulated the angiogenesis by promoting the mitochondrial functions. Oncotarget. 2017 Aug 18;8(44):77020-77027. doi: 10.18632/oncotarget.20331.
- De Aguiar RB, Zveiter de Moraes J. Exploring the Immunological Mechanisms Underlying the Anti-vascular Endothelial Growth Factor Activity in Tumors. Frontiers in Іmmunology. 1023 May 9;10:2019, doi: 10.3389/fimmu.2019.01023.
- Madureira G, Soares R. The misunderstood link between SARS-CoV-2 and angiogenesis. A narrative review. Pulmonology. 2023 Jul-Aug;29(4):323-331. doi: 10.1016/j.pulmoe.2021.08.004.
- Talotta R. Impaired VEGF-A-Mediated Neurovascular Crosstalk Induced by SARS-CoV-2 Spike Protein: A Potential Hypothesis Explaining Long COVID-19 Symptoms and COVID-19 Vaccine Side Effects? Microorganisms. 2022 Dec 12;10(12):2452. doi: 10.3390/microorganisms10122452.
- Josuttis D, Schwedler C, Heymann G, Gümbel D, Schmittner MD, Kruse M, Hoppe B. Vascular Endothelial Growth Factor as Potential Biomarker for COVID-19 Severity. J Intensive Care Med. 2023 Dec;38(12):1165-1173. doi: 10.1177/08850666231186787.
- Montazersaheb S, Hosseiniyan Khatibi SM, Hejazi MS, et al. COVID-19 infection: an overview on cytokine storm and related interventions. Virol J. 2022 May 26;19(1):92. doi: 10.1186/s12985-022-01814-1.
- Bonny TS, Patel EU, Zhu X, et al. Cytokine and Chemokine Levels in Coronavirus Disease 2019 Convalescent Plasma. Open Forum Infect Dis. 2020 Nov 26;8(2):ofaa574. doi: 10.1093/ofid/ofaa574.
- Chi Y, Ge Y, Wu B, et al. Serum Cytokine and Chemokine Profile in Relation to the Severity of Coronavirus Disease 2019 in China. J Infect Dis. 2020 Aug 4;222(5):746-754. doi: 10.1093/infdis/jiaa363.
- Monaci S, Coppola F, Filippi I, Falsini A, Carraro F, Naldini A. Targeting hypoxia signaling pathways in angiogenesis. Front Physiol. 2024 Apr 25;15:1408750. doi: 10.3389/fphys.2024.1408750.
- Serebrovska ZO, Chong EY, Serebrovska TV, Tumanov–ska LV, Xi L. Hypoxia, HIF-1α, and COVID-19: from pathoge–nic factors to potential therapeutic targets. Acta Pharmacol Sin. 2020 Dec;41(12):1539-1546. doi: 10.1038/s41401-020-00554-8.
- Heikal L, Ghezzi P, Mengozzi M, Ferns G. Assessment of HIF-1α expression and release following endothelial injury in-vitro and in-vivo. Mol Med. 2018 May 16;24(1):22. doi: 10.1186/s10020-018-0026-5. Erratum in: Mol Med. 2020 Jun 25;26(1):61. doi: 10.1186/s10020-020-00188-w.
- Tian M, Liu W, Li X, et al. HIF-1α promotes SARS-CoV-2 infection and aggravates inflammatory responses to COVID-19. Signal Transduct Target Ther. 2021 Aug 18;6(1):308. doi: 10.1038/s41392-021-00726-w.
- Wan Q, Song D, Li H, He ML. Stress proteins: the biological functions in virus infection, present and challenges for target-based antiviral drug development. Signal Transduct Target Ther. 2020 Jul 13;5(1):125. doi: 10.1038/s41392-020-00233-4.
- Scarlata GGM, Quirino A, Costache C, et al. Clostridioides difficile Infection: Use of Inflammatory Biomarkers and Hemogram-Derived Ratios to Predict Mortality Risk in Hospitalized Patients. Antibiotics (Basel). 2024 Aug 15;13(8):769. doi: 10.3390/antibio–tics13080769. PMID: 39200069; PMCID: PMC11352037.
- Abenavoli L, Aquila I, Sacco MA, et al. Liver Damage and Impaired Coagulation in COVID-19 Patients: A Case Series. Disea–ses. 2023 Oct 13;11(4):141. doi: 10.3390/diseases11040141. PMID: 37873785; PMCID: PMC10594514.
- Lai YJ, Liu SH, Manachevakul S, Lee TA, Kuo CT, Bello D. Biomarkers in long COVID-19: A systematic review. Front Med (Lausanne). 2023 Jan 20;10:1085988. doi: 10.3389/fmed.2023.1085988. PMID: 36744129; PMCID: PMC9895110.