Международный эндокринологический журнал Том 21, №2, 2025
Вернуться к номеру
Ефективність рифаксиміну в лікуванні пацієнтів із синдромом подразненого кишечника із запором та автоімунним тиреоїдитом з гіпотиреозом
Авторы: Yu.A. Onofrijchuk
Bogomolets National Medical University, Kyiv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
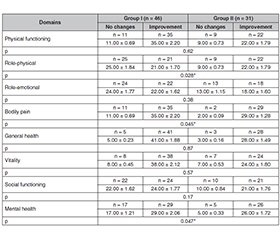
Актуальність. Синдром подразненого кишечника (СПК) є поширеною гастроінтестинальною ознакою розладу осі «кишечник — головний мозок», що проявляється у вигляді абдомінального болю, здуття живота та розладів випорожнень і може перебігати з переважанням запорів (СПК-З), діареї або в змішаній формі. Автоімунний тиреоїдит (АІТ) є найпоширенішим ендокринним розладом серед осіб молодого віку, що часто співіснує з СПК і впливає на його клінічний перебіг. Синдром надмірного бактеріального росту (СНБР) часто реєструється при обох захворюваннях. Лікування СНБР може поліпшити перебіг СПК. Метою дослідження є оцінка ефективності додаткового застосування препарату рифаксимін у лікуванні пацієнтів із СПК-З та АІТ з гіпотиреозом. Матеріали та методи. Це пілотне одноцентрове дослідження включало 77 пацієнтів із СПК-З та АІТ з гіпотиреозом. Усі учасники були розподілені на 2 групи: першу — 46 осіб, які отримували лікування згідно з клінічними настановами щодо ведення СПК, та другу — 31 пацієнт, який додатково отримував несистемний антибіотик рифаксимін. Визначення інтенсивності гастроінтестинальних симптомів: абдомінального болю, здуття живота, нудоти, блювання, печії та болю в епігастрії — проводилось із застосуванням 5-ступеневої шкали Лікерта. Для аналізу показників психологічного статусу використовували українську версію госпітальної шкали тривоги та депресії. Якість життя оцінювали за допомогою української версії опитувальника SF-36. Для діагностики СНБР було застосовано водневий дихальний тест з глюкозою. Статистичний аналіз виконано із використанням програмного забезпечення IBM SPSS Statistics 17 під управлінням Windows Vista (32-га редакція). Результати. Група пацієнтів, які додатково отримували препарат рифаксимін протягом 14 днів, продемонструвала вищу ефективність у зменшенні інтенсивності абдомінального болю (p = 0,037), проявів тривоги (p = 0,01) та депресії (p = 0,0007), нижчу поширеність СНБР (p ≤ 0,05) через 30 днів після завершення лікування (45-й день дослідження). Рівень водню в повітрі, що видихається, був вірогідно нижчим у цій групі. Показники якості життя за доменами «Біль», «Емоційне благополуччя» та «Обмеження ролі через фізичний стан» також були вірогідно кращими в групі рифаксиміну (p ≤ 0,05). Не спостерігалося вірогідної різниці в зміні проявів здуття живота, печії, нудоти, блювання та болю в епігастрії (p ≥ 0,05). Висновки. Додаткове застосування несистемного антибіотика рифаксимін продемонструвало вищу ефективність у зниженні інтенсивності абдомінального болю, проявів тривоги й депресії та поліпшенні показників якості життя в пацієнтів із СПК-З та АІТ з гіпотиреозом порівняно з терапією відповідно до клінічних настанов щодо ведення СПК-З. На 45-й день дослідження поширеність СНБР і рівень H2 були вірогідно нижчими в групі пацієнтів, які додатково отримували рифаксимін.
Background. Irritable bowel syndrome (IBS) is a common gastrointestinal sign of gut-brain axis disorder, which occurs with abdominal pain, bloating and abnormal bowel motility, and may be divided onto subtypes: with prevalence of constipation (IBS-C), diarrhea and mixed. Autoimmune thyroiditis (AIT) is the most prevalent endocrine disorder diagnosed in young patients, which can often coexist with IBS and influence its clinical course. Small intestinal bacterial overgrowth (SIBO) is usually registered in both disorders. SIBO treatment can improve the course of IBS. The purpose of the study is to assess the efficiency of additional use of rifaximin in treating patients with IBS-C and AIT with hypothyroidism. Materials and methods. It is a prospective single-centered study, which included 77 patients with IBS-C and AIT with hypothyroidism. All participants were divided into 2 groups: 46 people received clinical guideline IBS treatment (group I), and 31 patients took rifaximin additionally (group II). The intensiveness of gastrointestinal symptoms such as abdominal pain, bloating, nausea, vomiting, heartburn and epigastric pain was evaluated with the use of Likert 5-grade scale. The mental status was assessed with the Ukrainian version of Hospital Anxiety and Depression Scale. The quality of life was analyzed due to the score on the Ukrainian version of SF-36 survey. SIBO was diagnosed with the help of glucose hydrogen breath test. Statistical analysis was performed using IBM SPSS Statistics 17 software carried on Windows Vista (32-bit). Results. Patient group, which additionally used rifaximin for 14 days, demonstrated higher efficiency in abdominal pain relief (p = 0.037), decrease of anxiety (p = 0.01) and depression (p = 0.0007) level, and lower prevalence of SIBO (p ≤ 0.05) on the day 45 of the study. The hydrogen level in the exhaled air was significantly lower in this group. The quality-of-life domains “Bodily pain”, “Role emotional” and “Role physical” were significantly better in patients who received rifaximin (p ≤ 0.05). The significant difference was not observed in the intensiveness of bloating, heartburn, nausea, vomiting, and epigastric pain (p ≥ 0.05). Conclusions. The additional use of non-systemic antibiotic rifaximin demonstrated higher efficiency in decreasing abdominal pain intensiveness, improving anxiety and depression and quality of life levels in patients with IBS-C and AIT with hypothyroidism compared to the clinical guideline IBS-C management. SIBO prevalence and H2 levels were significantly lower on the day 45 of the study in patients who received rifaximin.
синдром подразненого кишечника; запор; автоімунний тиреоїдит; гіпотиреоз; рифаксимін; кишкова мікробіота; синдром надмірного бактеріального росту
irritable bowel syndrome; constipation; autoimmune thyroiditis; hypothyroidism; rifaximin; gut microbiome; small intestinal bacterial overgrowth
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Sperber AD, Bangdiwala SI, Drossman DA, Ghoshal UC, Simren M, et al. Worldwide prevalence and burden of functional gastrointestinal disorders, results of Rome Foundation Global Study. Gastroenterology. 2021 Jan;160(1):99-114.e3. doi: 10.1053/j.gastro.2020.04.014.
- Chey WD, Shah ED, DuPont HL. Mechanism of action and therapeutic benefit of rifaximin in patients with irritable bowel syndrome: a narrative review. Therap Adv Gastroenterol. 2020 Jan 23;13:1756284819897531. doi: 10.1177/1756284819897531.
- Drossman DA, Morris CB, Schneck S, Hu YJ, Norton NJ, et al. International survey of patients with IBS: symptom features and their severity, health status, treatments, and risk taking to achieve clinical benefit. J Clin Gastroenterol. 2009 Jul;43(6):541-50. doi: 10.1097/MCG.0b013e318189a7f9.
- Onana Ndong P, Boutallaka H, Marine-Barjoan E, Ouizeman D, Mroue R, et al. Prevalence of small intestinal bacterial overgrowth in irritable bowel syndrome (IBS): correlating H2 or CH4 production with severity of IBS. JGH Open. 2023 Apr 3;7(4):311-320. doi: 10.1002/jgh3.12899.
- Sachdeva S, Rawat AK, Reddy RS, Puri AS. Small intestinal bacterial overgrowth (SIBO) in irritable bowel syndrome: frequency and predictors. J Gastroenterol Hepatol. 2011 Apr;26 Suppl 3:135-8. doi: 10.1111/j.1440-1746.2011.06654.x.
- Hu X, Chen Y, Shen Y, Tian R, Sheng Y, Que H. Global pre–valence and epidemiological trends of Hashimoto’s thyroiditis in adults: a systematic review and meta-analysis. Front Public Health. 2022 Oct 13;10:1020709. doi: 10.3389/fpubh.2022.1020709.
- Pankiv V. Coexistence of accompanying autoimmune di–seases in adolescents with autoimmune thyroiditis. Child’s Health. 2024;19(7):429-433. doi: 10.22141/2224-0551.19.7.2024.1754.
- Настанова 00184. Функціональні захворювання кишечника та синдром подразненого кишечника (СПК). Available from: http://guidelines.moz.gov.ua/documents/2918?id = ebm00184&format = pdf.
- Chang L, Sultan S, Lembo A, Verne GN, Smalley W, Heidelbaugh JJ. AGA Clinical Practice Guideline on the Pharmacologi–cal Management of Irritable Bowel Syndrome With Constipation. Gastroenterology. 2022 Jul;163(1):118-136. doi: 10.1053/j.gastro.2022.04.016.
- Quigley EMM, Murray JA, Pimentel M. AGA Clinical Practice Update on Small Intestinal Bacterial Overgrowth: Expert Review. Gastroenterology. 2020 Oct;159(4):1526-1532. doi: 10.1053/j.gastro.2020.06.090.
- Lacy BE, Chang L, Rao SSC, Heimanson Z, Sayuk GS. Rifaximin Treatment for Individual and Multiple Symptoms of Irritable Bowel Syndrome With Diarrhea: An Analysis Using New End Points. Clin Ther. 2023 Mar;45(3):198-209. doi: 10.1016/j.clinthera.2023.01.010.
- Lijia Chang, Yan Wei, Kenji Hashimoto. Brain-gut-micro–biota axis in depression: a historical overview and future directions. Brain Res Bull. 2022;182:44-56. doi: 10.1016/j.brainresbull.2022.02.004.
- Pimentel M, Lembo A, Chey WD, Zakko S, Ringel Y, et al.; TARGET Study Group. Rifaximin therapy for patients with irritable bowel syndrome without constipation. N Engl J Med. 2011 Jan 6;364(1):22-32. doi: 10.1056/NEJMoa1004409.
- Pimentel M. Review article: potential mechanisms of action of rifaximin in the management of irritable bowel syndrome with diarrhoea. Aliment Pharmacol Ther. 2016 Jan;43 Suppl 1:37-49. doi: 10.1111/apt.13437.
- Ghoshal UC, Srivastava D, Misra A. A randomized double-blind placebo-controlled trial showing rifaximin to improve constipation by reducing methane production and accelerating colon transit: a pilot study. Indian J Gastroenterol. 2018 Sep;37(5):416-423. doi: 10.1007/s12664-018-0901-6.
- Karki B, Sherpa TW, Deo RK, Thapa P. Clinical response to rifaximin amongst irritable bowel syndrome (IBS) patients at tertiary level hospital in Nepal. J Patan Acad Health Sci. 2024;11(1):21-26. doi: 10.3126/jpahs.v11i1.65652.
- Hammer HF, Fox MR, Keller J, Salvatore S, Basilisco G, Hammer J, et al. European guideline on indications, performance, and clinical impact of hydrogen and methane breath tests in adult and pediatric patients: European Association for Gastroenterology, Endoscopy and Nutrition, European Society of Neurogastroenterology and Motility, and European Society for Paediatric Gastroenterology Hepatology and Nutrition consensus. United Eur Gastroenterol J. 2022 Feb;10(1):15-40. doi: 10.1002/ueg2.12133.
- Tansel A, Levinthal DJ. Understanding our tests: hydrogen-methane breath testing to diagnose small intestinal bacterial overgrowth. Clin Transl Gastroenterol. 2023 Apr 1;14(4):e00567. doi: 10.14309/ctg.0000000000000567.
- Zeber-Lubecka N, Kulecka M, Ambrozkiewicz F, Paziew–ska A, Goryca K, et al. Limited prolonged effects of rifaximin treatment on irritable bowel syndrome-related differences in the fecal microbiome and metabolome. Gut Microbes. 2016 Sep 2;7(5):397-413. doi: 10.1080/19490976.2016.1215805.
- Mokhtare M, Fathi M, Sadeghian AM, Sotoudeheian MJ, Namazi A. A Pilot Study of the Effectiveness of a Short Course of Rifa–ximin 2200 mg/day on Abdominal Symptoms and its Effects on Quality of Life in Patients with Moderate to Severe Diarrhea-Predominant Irritable Bowel Syndrome. Clin Drug Investig. 2024 Nov;44(11):839-847. doi: 10.1007/s40261-024-01403-w.
- Onofrijchuk JA, Svintsitskyi IA, Solovyova GA. Gut microbiome composition and frequency of small intestinal bacterial overgrowth in patients with irritable bowel syndrome with constipation and hypothyroid Hashimoto’s thyroiditis: a pilot single-center, cross-sectional study. Endokrynologia. 2024;30(4). doi: 10.31793/1680-1466.2024.29-4.324.
- Shah A, Talley NJ, Jones M, Kendall BJ, Koloski N, Wal–ker MM, et al. Small intestinal bacterial overgrowth in irritable bowel syndrome: a systematic review and meta-analysis of case-control stu–dies. Am J Gastroenterol. 2020 Feb;115(2):190-201. doi: 10.14309/ajg.0000000000000504.
- Pimentel M, Chang C, Chua KS, Mirocha J, DiBaise J, Rao S, Amichai M. Antibiotic treatment of constipation-predominant irritable bowel syndrome. Dig Dis Sci. 2014 Jun;59(6):1278-85. doi: 10.1007/s10620-014-3157-8.
- Deljavan Ghodrati A, Comoglu T. Rifaximin and alternative agents in the management of irritable bowel syndrome: A comprehensive review. Arch Pharm (Weinheim). 2024 Oct;357(10):e2400356. doi: 10.1002/ardp.202400356.
- Henderson BB, Smith SP, Mengelkamp ME, Rhymer EK, Gray KN, et al. Liquid thyroxine improves outcomes in hypothyroid patients with small intestinal bacterial overgrowth and irritable bowel syndrome. Endocr Pract. 2024 Jun;30(6):505-512. doi: 10.1016/j.eprac.2024.03.005.
- Zhang M, Xu Y, Sun Z, Ban Y, Zhai S, et al. Evaluation of probiotics in the treatment of hypothyroidism in early pregnancy combined with small intestinal bacterial overgrowth. Food Sci Nutr. 2024 Jan 22;12(4):2671-2678. doi: 10.1002/fsn3.3948.
- Zhu X, Zhang C, Feng S, He R, Zhang S. Intestinal microbiota regulates the gut-thyroid axis: the new dawn of improving Hashimoto thyroiditis. Clin Exp Med. 2024 Feb 22;24(1):39. doi: 10.1007/s10238-024-01304-4.
- Chojnacki C, et al. The effect of rifaximin treatment for small intestinal bacterial overgrowth on thyroid disorders. Int J Med Clin Res. 2017;8(2):359-363.