Международный эндокринологический журнал Том 21, №3, 2025
Вернуться к номеру
Рецидивуючий фурункульоз у пацієнтів з цукровим діабетом 1-го типу: імунопатологія та можливості медикаментозної корекції
Авторы: Господарська Х.О. (1), Господарський І.Я. (1, 2)
(1) - Медичний центр «Клініка Господарських», м. Тернопіль, Україна
(2) - Тернопільський національний медичний університет імені І.Я. Горбачевського, м. Тернопіль, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
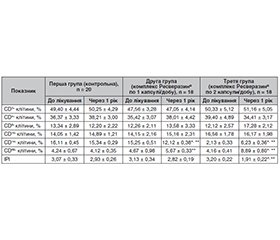
Мета роботи: вивчити стан імунної відповіді у пацієнтів з рецидивуючим фурункульозом (РФ) на тлі цукрового діабету 1-го типу (ЦД1) і можливості його корекції. Матеріали та методи. Обстежено 56 пацієнтів з ЦД1, які мали не менше ніж 5 клінічних епізодів фурункульозу впродовж останнього календарного року. У всіх пацієнтів визначали показники клітинного імунітету, після чого ці хворі були рандомізовані на 3 групи і отримували різне лікування протягом наступних 3 місяців. Пацієнти першої групи (20 хворих) отримували стандартну терапію із застосуванням антибіотиків і місцевих антисептиків, за необхідності — хірургічну допомогу. 18 особам другої групи додатково призначали комплекс Ресверазин® у дозі 1 капсула на добу впродовж 3 місяців. Пацієнти третьої групи (18 осіб) отримували комплекс Ресверазин® по 2 капсули на добу протягом того ж часу. Після завершення 3-місячного періоду повторно визначали показники імунної відповіді. Також в усіх пацієнтів реєстрували частоту рецидивів фурункульозу, потребу в застосуванні антибіотиків і частоту звернень по хірургічну допомогу впродовж наступного календарного року. Результати. У пацієнтів з ЦД1 і РФ виявлене суттєве зростання рівня клітин моноцитарно-макрофагального ряду (CD14+, p < 0,05 щодо норми), які характеризуються високою автоімунною активністю при ЦД1, а також вірогідне зниження рівня клітин моноцитарно-макрофагального ряду з активністю М1 макрофагів (CD68+, p < 0,05 щодо норми), що може бути предиктором зниження протиінфекційного захисту. Призначення комплексу Ресверазин® сприяє зниженню інтенсивності автоімунного запального процесу, відновленню ІРІ (p < 0,05), супроводжується зниженням рівня макрофагів, які беруть участь в автоімунних реакціях (p < 0,05), і збільшенням рівня клітин моноцитарно-макрофагального ряду з активністю М1 макрофагів (CD68+, p < 0,05), які беруть участь у протимікробному захисті. Результатом стало зменшення частоти рецидивів гнійничкових уражень шкіри (p < 0,05), а також вірогідне зниження потреби в антибіотиках упродовж 1 року спостереження (p < 0,05) і необхідності хірургічних втручань (p < 0,05). У випадку 2-разового прийому комплексу Ресверазин® на добу описані вище ефекти були більш вираженими, а головне — більш стійкими: отриманий результат спостерігався протягом 1 року. При застосуванні комплексу Ресверазин® не виникало жодних серйозних небажаних побічних ефектів, які б змусили припинити його прийом. Висновки. У пацієнтів з ЦД1 і РФ виявлені суттєві зміни в стані клітинного імунітету, що проявлялися змінами у кількості і співвідношенні клітин моноцитарно-макрофагального ряду. Призначення комплексу Ресверазин® супроводжувалося відновленням цих змін. Застосування комплексу Ресверазин® протягом 3 місяців супроводжувалося дозозалежним зменшенням числа рецидивів фурункульозу у хворих на ЦД1 і вірогідно зменшувало потребу в антибіотиках, а також частоту хірургічних втручань.
Background. The purpose of the work is to study the state of the immune response in patients with recurrent furunculosis against the background of type 1 diabetes mellitus (DM1) and the possibility of its correction. Materials and methods. Fifty-six patients with DM1 who had at least 5 clinical episodes of furunculosis during the last calendar year were examined. Cellular immunity indicators were studied in all participants, after which they were randomized into 3 groups and received different treatments over the next 3 months. Patients of the first group (n = 20) received standard therapy with the use of antibiotics and local antiseptics, surgical care if necessary. Eighteen people of the second group were additionally prescribed Resverasin® at a dose of 1 capsule per day for 3 months. Group 3 patients (n = 18) received Resverasin® 2 capsules per day for the same time. After the completion of the 3-month period, the indicators of the immune response were redetermined. Also, the frequency of furunculosis recurrences, the need for antibiotics and the frequency of surgical visits during the next calendar year were recorded in all participants. Results. In patients with DM1 and recurrent furunculosis, there was a significant increase in the level of cells of the monocyte-macrophage series (CD14+, p < 0.05 relative to the norm), which are characterized by high autoimmune activity in DM1, as well as a significant decrease in the level of cells of the monocyte-macrophage series with the activity of M1 macrophages (CD68+, p < 0.05 relative to the norm), which may be a predictor of a decrease in anti-infective defense. The prescription of Resverasin® helps reduce the intensity of the autoimmune inflammation, restore immunoregulatory index (p < 0.05), and is accompanied by a decrease in the level of macrophages involved in autoimmune reactions (p < 0.05) and an increase in the level of cells of the monocyte-macrophage series with the activity of M1 macrophages (CD68+, p < 0.05) involved in antimicrobial defense. The result was a decrease in the frequency of recurrences of pustular skin lesions (p < 0.05), as well as a significant reduction in the need for antibiotics during 1 year of follow-up (p < 0.05) and the need for surgical interventions (p < 0.05). In case of administering 2 doses of Resverasin® per day, the effects described above were more pronounced, and most importantly, more persistent: the result obtained was observed for 1 year. When using Resverasin®, there were no serious side effects that would force you to stop taking it. Conclusions. In patients with DM1 and recurrent furunculosis, significant changes in the state of cellular immunity were revealed, which were manifested by changes in the number and ratio of cells of the monocyte-macrophage series. The administration of Resverasin® was accompanied by the restoration of these changes. The use of Resverasin® for 3 months was accompanied by a dose-dependent decrease in the number of furunculosis recurrences in patients with DM1 and significantly reduced the need for antibiotics and the frequency of surgical interventions.
цукровий діабет 1-го типу; рецидивуючий фурункульоз; ресвератрол; фагоцитоз; імунна відповідь
type 1 diabetes mellitus; recurrent furunculosis; resveratrol; phagocytosis; immune response
Вступ
Матеріали та методи
Результати
Висновки
- Zha M, Usatine R. Common Skin Conditions in Children and Adolescents: Bacterial Infections. FP Essent. 2024 Jun;541:14-19. PMID: 38896826.
- Iwabuchi C, Hino H, Shimada K, Kaneko H, Nakaminami H. Recurrent furunculosis by Panton-Valentine leukocidin-positive methicillin-resistant Staphylococcus aureus USA300 clone in Tokyo: A report of two cases. J Dermatol. 2021 Oct;48(10):E522-E523. doi: 10.1111/1346-8138.16076. Epub 2021 Jul 22. PMID: 34296468.
- Balakirski G, Hischebeth G, Altengarten J, Exner D, Bieber T, Dohmen J, Engelhart S. Recurrent mucocutaneous infections caused by PVL-positive Staphylococcus aureus strains: a challenge in clini–cal practice. J Dtsch Dermatol Ges. 2020 Apr;18(4):315-322. doi: 10.1111/ddg.14058. Epub 2020 Mar 20. PMID: 32196137.
- Ibler KS, Kromann CB. Recurrent furunculosis — challenges and management: a review. Clin Cosmet Investig Dermatol. 2014 Feb 18;7:59-64. doi: 10.2147/CCID.S35302. PMID: 24591845; PMCID: PMC3934592.
- Demos M, McLeod MP, Nouri K. Recurrent furunculosis: a review of the literature. Br J Dermatol. 2012 Oct;167(4):725-32. doi: 10.1111/j.1365-2133.2012.11151.x. PMID: 22803835.
- Nowicka D, Grywalska E. Staphylococcus aureus and Host Immunity in Recurrent Furunculosis. Dermatology. 2019;235(4):295-305. doi: 10.1159/000499184. Epub 2019 Apr 17. PMID: 30995649.
- Prokopchuk O, Hospodarskyy I, Kozak O, Gavryliuk N, Danchak S. Possibility of non-invasive diagnostics of liver fibrosis in patients after chemotherapy with normal weight and overweight. Romanian Journal of Diabetes, Nutrition and Metabolic Diseases. 2022;29(4):451-456. DOI: 10.46389/rjd-2022-1196.
- Andrejczyn M, Wasyliewa N, Gospodarski I. Some aspects of epidemiology of HCV infections in Ukraine. Przegląd epidemiologiczny.2005;59(2):499-501. PMID: 16190559.
- Keystone EC, Shirinsky VS, Simon LS, et al. Efficacy and safety of CH-1504, a metabolically stable antifolate, in patients with active rheumatoid arthritis: Results of a phase II multicenter randomized study. J Rheumatol. 2011;38(9):1875-83. doi: 10.3899/jrheum.101038.
- Montgomery CP, David MZ, Daum RS. Host factors that contribute to recurrent staphylococcal skin infection. Curr Opin Infect Dis. 2015 Jun;28(3):253-8. doi: 10.1097/QCO.0000000000000156. PMID: 25887613; PMCID: PMC4414914.
- Nowicka D, Grywalska E, Surdacka A, Grafka A, Roliński J. Frequencies of PD-1- and PD-L1- positive T CD3+CD4+, T CD3+CD8+ and B CD19+ lymphocytes and its correlations with other immune cells in patients with recurrent furunculosis. Microb Pathog. 2019 Jan;126:85-91. doi: 10.1016/j.micpath.2018.10.019. Epub 2018 Oct 19. PMID: 30342909.
- Sánchez-Zamora YI, Juarez-Avelar I, Vazquez-Mendoza A, Hiriart M, Rodriguez-Sosa M. Altered Macrophage and Dendritic Cell Response in Mif-/- Mice Reveals a Role of Mif for Inflammatory-Th1 Response in Type 1 Diabetes. J Diabetes Res. 2016;2016:7053963. doi: 10.1155/2016/7053963. Epub 2016 Sep 6. PMID: 27699180; PMCID: PMC5028830.
- Ryba-Stanisławowska M, Myśliwska J, Juhas U, Myśliwiec M. Elevated levels of peripheral blood CD14brightCD16+ and CD14dimCD16+ monocytes may contribute to the development of retinopathy in patients with juvenile onset type 1 diabetes. APMIS. 2015;123:793-799. https://doi.org/10.1111/apm.12419.
- Wainman HE, Lane PC, Ingram JR. Hidradenitis suppurativa diagnosis and management in primary care: not just recurrent boils. Br J Gen Pract. 2022 Dec 21;73(726):43-45. doi: 10.3399/bjgp23X731733. PMID: 36543559; PMCID: PMC9799356.
- Simor AE, Phillips E, McGeer A, et al. Randomized controlled trial of chlorhexidine gluconate for washing, intranasal mupirocin, and rifampin and doxycycline versus no treatment for the eradication of methicillin-resistant Staphylococcus aureus colonization. Clin Infect Dis. 2007;44:178-185. doi: 10.1086/510392.
- Lin HS, Lin PT, Tsai YS, Wang SH, Chi CC. Interventions for bacterial folliculitis and boils (furuncles and carbuncles). Cochrane Database Syst Rev. 2021 Feb 26;2(2):CD013099. doi: 10.1002/14651858.CD013099.pub2. PMID: 33634465; PMCID: PMC8130991.
- Atanaskova N, Tomecki KJ. Innovative management of recurrent furunculosis. Dermatol Clin. 2010;28:479-487. doi: 10.1016/j.det.2010.03.013.
- Ren B, Kwah MX, Liu C, Ma Z, Shanmugam MK, Ding L, et al. Resveratrol for cancer therapy: Challenges and future perspectives. Cancer Lett. 2021 Sep 1;515:63-72. doi: 10.1016/j.canlet.2021.05.001. Epub 2021 May 28. PMID: 34052324.
- Breuss JM, Atanasov AG, Uhrin P. Resveratrol and Its Effects on the Vascular System. Int J Mol Sci. 2019 Mar 27;20(7):1523. doi: 10.3390/ijms20071523. PMID: 30934670; PMCID: PMC6479680.
- Pignet AL, Schellnegger M, Hecker A, Kohlhauser M, Kotzbeck P, Kamolz LP. Resveratrol-Induced Signal Transduction in Wound Healing. Int J Mol Sci. 2021 Nov 23;22(23):12614. doi: 10.3390/ijms222312614. PMID: 34884419; PMCID: PMC8657598.
- Kai Liu, Rui Zhou, Bin Wang, Man-Tian Mi. Effect of resveratrol on glucose control and insulin sensitivity: a meta-analysis of 11 randomized controlled trials. The American Journal of Clinical Nutrition. 2014;99(6):1510-1519. doi: 10.3945/ajcn.113.082024.

/67.jpg)
/68.jpg)