Международный эндокринологический журнал Том 21, №5, 2025
Вернуться к номеру
Аскаридоз, акне та гінекологічні розлади: роль гормонального та коагуляційного дисбалансу
Авторы: V.О. Sklyarovа (1, 2), T.P. Yavorska (1), R.A. Chaikivskyi1, O.M. Nepyivoda1, 3, O.V. Prykupenko1, V.R. Chaikivska1
(1) - Danylo Halytsky Lviv National Medical University, Lviv, Ukraine
(2) - Lviv Regional Hospital for War Veterans and Repressed named after Yu. Lypa, Lviv, Ukraine
(3) - Emergency Hospital of Lviv, Lviv, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
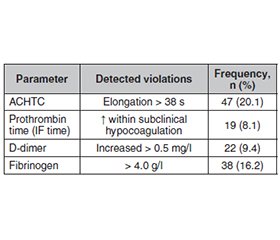
Актуальність. Аскаридоз залишається однією з найпоширеніших глистяних інфекцій у світі, особливо в країнах із помірним кліматом, включаючи Україну. Проблема залишається недостатньо вивченою та клінічно недооціненою в галузі амбулаторної гінекології та первинної медичної допомоги. Мета: вивчити взаємозв’язок між аскаридозом, гінекологічними захворюваннями, гормональними порушеннями, тромбоцитозом та дерматологічними проявами у жінок репродуктивного віку. Матеріали та методи. Обстежено 234 жінки віком 18–47 років зі скаргами на патологічні вагінальні виділення, висипання на шкірі обличчя, порушення менструального циклу й розлади з боку шлунково-кишкового тракту. Усім пацієнткам проведено паразитологічні, гінекологічні, гормональні, дерматологічні та гематологічні обстеження, включаючи визначення рівня тромбоцитів і коагулограму. Результати. У 83,8 % жінок виявлено яйця Ascaris lumbricoides, у 12 % — цисти лямблій. Характерні висипання на шкірі обличчя, що поєднувались із бактеріальним вагінозом, кандидозом, псевдоерозіями шийки матки, хронічним сальпінгоофоритом, мали 80,3 % пацієнток. Гормональне обстеження засвідчило підвищення кортизолу в 78 % випадків та дисбаланс естроген-прогестеронового профілю — у 62,7 %. У 26,5 % пацієнток діагностовано тромбоцитоз, що корелював із хронічними запальними процесами статевих органів. Тромбоцитоз зафіксовано у 62 (26,5 %) обстежених жінок, тромбоцитопенію — у 27, а подовжений активований тромбопластиновий час — у 20 %. У 86 % випадків діагностовано запальні гінекологічні захворювання (ендоцервіцит, сальпінгоофорит, ендометріоз, бактеріальний вагіноз). У 78 % пацієнток з акне й аскаридозом виявлено підвищений рівень кортизолу, а у 63 % — гормональний дисбаланс (гіпоестрогенія або відносна гіперестрогенія). Специфічні висипання в нижній третині обличчя з’являлися перед менструацією або після стресу. Висновки. Аскаридоз є мультисистемною патологією, яка асоціюється з гінекологічними порушеннями, гормональним дисбалансом, тромбоцитарною реакцією та шкірними проявами. Комплексна діагностика в гінекологічних хворих має включати обстеження на гельмінтози, вивчення коагулограми та гормонального профілю.
Background. Ascariasis remains one of the most common helminth infections in the world, particularly in countries with temperate climates, including Ukraine. The problem remains understudied and clinically underestimated in the field of outpatient gynaecology and primary care. The aim was to determine the relationship between the presence of ascariasis, skin rashes on the face, gynaecological diseases, changes in hormonal status and blood clotting disorders in women of reproductive age. Materials and methods. A total of 234 women aged 18 to 47 years who consulted a gynaecologist for vaginal discharge and had characteristic rashes on the skin of the face were examined. The comprehensive examination included: gynaecological examination, microscopy of smears, ultrasound of the pelvic organs and abdominal cavity, laboratory analysis of faeces for helminth eggs, examination for demodicosis, hormonal profile (oestrogens, cortisol), coagulogram, and clinical blood and urine tests. The control group consisted of 20 women with no signs of parasitic infestation or gynaecological pathology. Results. Ascaris lumbricoides eggs were found in the stool of 196 women (83.8 %), and Giardia cysts were also detected in 13 patients. Thrombocytosis was recorded in 62 (26.5 %) of the examined women, thrombocytopenia in 27, and prolonged activated partial thromboplastin time in 20 %. In 86 % of cases, inflammatory gynaecological diseases (endocervicitis, salpingo-oophoritis, endometriosis, bacterial vaginosis) were diagnosed. In 78 % of patients with acne and ascariasis, elevated cortisol levels were detected, and in 63 % — hormonal imbalance (hypoestrogenism or relative hyperestrogenism). Specific rashes in the lower third of the face appeared before menstruation or after stress. Conclusions. Women with ascariasis have a characteristic clinical triad: skin rashes (acne), gynaecological inflammatory diseases and dysbiosis caused by parasitic invasion, changes in immune and hormonal status, as well as disorders of the coagulation system. It is advisable to include parasitological and coagulation tests in the diagnostic algorithm for patients with recurrent acne, bacterial vaginosis, and endometriosis.
аскаридоз; акне; гормональний дисбаланс; тромбоцитоз; естрогени; кортизол; бактеріальний вагіноз; гінекологічні захворювання; дисбіоз
ascariasis; acne; hormonal imbalance; thrombocytosis; oestrogens; cortisol; bacterial vaginosis; gynaecological diseases; dysbiosis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- World Health Organization (WHO). World Health Statistics 2023: Monitoring health for the SDGs, sustainable development goals. Geneva: World Health Organization; 2023. 119 p.
- Deku JG, Okyere DO, Buabeng S, et al. The burden and trend of intestinal parasitosis among women at Berekum, Ghana: a 9-year retrospective study. BMC Infect Dis. 2024;24(1):1287. doi: 10.1186/s12879-024-10188-4.
- Shen Y, Fan N, Ma SX, Cheng X, Yang X, Wang G. Gut Microbiota Dysbiosis: Pathogenesis, Diseases, Prevention, and Therapy. MedComm (2020). 2025;6(5):e70168. doi: 10.1002/mco2.70168.
- Herman JP, McKlveen JM, Ghosal S, et al. Regulation of the Hypothalamic-Pituitary-Adrenocortical Stress Response. Compr Physiol. 2016;6(2):603-621. doi: 10.1002/cphy.c150015.
- Vanhooren M, Stoefs A, van Den Broucke S, van Esbroeck M, Demuyser T, Kindt S. Intestinal helminthic infections: a narrative review to guide the hepatogastroenterologist. Acta Gastroenterol Belg. 2023;86(3):460-473. doi: 10.51821/86.3.11895.
- Messelink B, Flink I, Dos Santos A, Adamse C. Chronic pelvic pain; more than just the bladder. Curr Opin Urol. 2024;34(2):69-76. doi: 10.1097/mou.0000000000001134.
- Kaminsky R, Mäser P. Global impact of parasitic infections and the importance of parasite control. Front Parasitol. 2025;4:1546195. doi: 10.3389/fpara.2025.1546195.
- Pankiv VI. Coexistence of accompanying autoimmune diseases in adolescents with autoimmune thyroiditis. Child’s Health. 2024;19(7):429-433. doi: 10.22141/2224-0551.19.7.2024.1754.
- Mias C, Mengeaud V, Bessou-Touya S, Duplan H. Recent advances in understanding inflammatory acne: Deciphering the relationship between Cutibacterium acnes and Th17 inflammatory pathway. J Eur Acad Dermatol Venereol. 2023;37(Suppl 2):3-11. doi: 10.1111/jdv.18794.
- Romano MC, Jiménez P, Miranda-Brito C, Valdez RA. Para–sites and steroid hormones: corticosteroid and sex steroid synthesis, their role in the parasite physiology and development. Front Neurosci. 2015;9:224. doi: 10.3389/fnins.2015.00224.
- Nagornyuk VT. The influence of transmitted parasitic infections during pregnancy on fetal immunity system (literature review). Ukr J Health Woman. 2023;5(168):42-46. doi: 10.15574/hw.2023.168.42 (in Ukrainian).
- Wang Y, Liu Z, Chen T. Vaginal microbiota: Potential targets for vulvovaginal candidiasis infection. Heliyon. 2024;10(5):e27239. doi: 10.1016/j.heliyon.2024.e27239.
- Diosdado A, Simón F, Serrat J, González-Miguel J. Interaction of helminth parasites with the haemostatic system of their vertebrate hosts: a scoping review. Parasite. 2022;29:35. doi: 10.1051/parasite/2022034.
- Diosdado A, Simón F, Morchón R, González-Miguel J. Host-parasite relationships in porcine ascariosis: anticoagulant potential of the third larval stage of Ascaris suum as a possible survival mechanism. Animals. 2021;11(3):804. doi: 10.3390/ani11030804.
- Li H, Shan C, Zhu Y, et al. Helminth-induced immune modu–lation in colorectal cancer: exploring therapeutic applications. Front Immunol. 2025;16:1484686. doi: 10.3389/fimmu.2025.1484686.
- Chrousos GP. Stress and disorders of the stress system. Nat Rev Endocrinol. 2009;5(7):374-381. doi: 10.1038/nrendo.2009.106.
- Bataa M, Abdelmessih E, Hanna F. Exploring Progesterone Deficiency in First-Trimester Miscarriage and the Impact of Hormone Therapy on Foetal Development: A Scoping Review. Children (Basel). 2024;11(4):422. doi: 10.3390/children11040422.
- Bortot B, Di Florio R, Merighi S, et al. Platelets as key cells in endometriosis patients: Insights from small extracellular vesicles in peritoneal fluid and endometriotic lesions analysis. FASEB J. 2024;38(24):e70267. doi: 10.1096/fj.202402499r.
- Prylutska AB, Avramenko S, Kisilenko OL, Govsieiev DO. Modern approaches to diagnosing the course of the wound process in parturient women with obstetric surgical wound infection. Ukr J Health Woman. 2024;6(175):37-42. doi: 10.15574/hw.2024.6(175).3742 (in Ukrainian).
- Saric-Bosanac S, Clark AK, Sivamani RK, Shi VY. The role of hypothalamus-pituitary-adrenal (HPA)-like axis in inflammatory pilosebaceous disorders. Dermatol Online J. 2020;26(2):13030/qt8949296f.
- Sklyarova VO. Vaginal microbiocinosis in women with infertility and parasite invasion. Int STD Res Rev. 2015;3(3):123-130. doi: 10.9734/isrr/2015/20425.