Международный эндокринологический журнал Том 21, №5, 2025
Вернуться к номеру
Стан гормонального балансу у жінок з аденоміозом відповідно до фаз менструального циклу та його залежність від стадії захворювання
Авторы: Семенина Г.Б. (1), Мандзій І.М. (2), Попович А.І. (1), Коритко О.О. (1), Дорошенко-Кравчик М.В. (1), Попович О.І. (1)
(1) - Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
(2) - Хмельницький міський перинатальний центр, м. Хмельницький, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
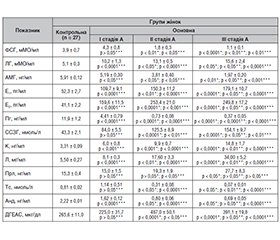
Актуальність. Аденоміоз — різновид генітального ендометріозу, при якому гетеротопії ендометріоїдної тканини виявляються у міометрії, що супроводжується значними порушеннями репродуктивної та менструальної функцій, стійким больовим синдромом, дисфункцією суміжних органів, погіршенням загального стану пацієнток і зниженням працездатності. Незаперечним учасником патологічного процесу в генезі аденоміозу є зміни у нейроендокринній ланці репродуктивної системи, характеристика та глибина вираженості яких залишаються не з’ясованими. Мета: провести дослідження стану гормонального балансу у жінок з аденоміозом у фолікулярній і лютеїновій фазах менструального циклу та з’ясувати його зв’язок зі стадією та клінічними проявами захворювання. Матеріали та методи. Під спостереженням перебували 97 жінок репродуктивного віку, з них 67 були з діагнозом «аденоміоз» (основна група) та 30 здорових (контрольна група). Стадію аденоміозу оцінювали за критеріями, описаними Squtrito і співавт. Гормональні дослідження включали визначення фолікулостимулюючого гормону, лютеїнізуючого гормону, сексстероїдзв’язуючого глобуліну, прогестерону, естрадіолу, пролактину, кортизолу, тестостерону, андростендіону, дегідроепіандростерону, антимюллерового гормону, лептину у фолікулярній і лютеїновій фазах менструального циклу. Для моніторингу якості життя пацієнток проводили оцінку больового синдрому за візуальною аналоговою шкалою. Статистична обробка одержаних даних проводилася за допомогою стандартного пакета програм StatSoft Statistica for Windows 13.0. Результати. У фолікулярній фазі менструального циклу зазнали змін усі гормони гіпофізарно-яєчникової осі, глибина яких корелює з тяжкістю захворювання. Вміст естрогенів невпинно зростає у сироватці крові жінок з аденоміозом порівняно з контрольною групою (р < 0,0001), особливо помітним є зростання вмісту не тільки естрадіолу, що є фізіологічним за даних умов, але й естрону. Виявили зниження вмісту прогестерону й андрогенів, що поглиблювалося зі зростанням стадії захворювання. Вміст стресових гормонів був найвищим у другій фазі менструального циклу та корелював із больовим синдромом (r = 0,91; p < 0,01). У дослідженні виявили підвищення вмісту лептину у жінок основної групи порівняно з контрольною, яке починається з ІІ стадії (р < 0,0001), прогресивно зростає з тяжкістю аденоміозу, перевищуючи референтні норми більш як утричі при ІІІ стадії захворювання (р < 0,0001), що свідчить про залученість до патогенезу обмінно-метаболічних процесів. Висновки. Роль змін метаболізму і режиму статевих гормонів, нейроендокринних порушень системи «гіпоталамус — гіпофіз — яєчники» у патогенезі аденоміозу є безсумнівною. Найвираженішими є зміни в естроген-гестагенній системі, тяжкість яких корелює зі стадією захворювання. У всіх хворих на аденоміоз ІІІ стадії є підвищення вмісту стресових гормонів, що корелює із силою больового синдрому (r= –0,82; p < 0,05). Вміст тестостерону при аденоміозі є зниженим і корелює із вмістом кортизолу (r= –0,67; p < 0,05). Виявлене вірогідне підвищення вмісту лептину у жінок з аденоміозом порівняно зі здоровими зростає зі ступенем тяжкості захворювання і дозволяє вважати аденоміоз мультисистемним захворюванням.
Background. Adenomyosis is a type of genital endometriosis in which heterotopias of endometrioid tissue are found in the myometrium that is accompanied by significant disorders of reproductive and menstrual functions, persistent pain syndrome, dysfunction of adjacent organs, deterioration of the general condition of patients, and decreased work capacity. An undeniable participant in the pathological process in the adenomyosis origin are changes in the neuroendocrine link of the reproductive system whose characteristics and depth of manifestation remain unclear. Aim: to conduct a study of the state of hormonal balance in women with adenomyosis in the follicular and luteal phases of the menstrual cycle and to determine its relationship with the stage and clinical manifestations of the disease. Materials and methods. Ninety-seven women of reproductive age were under observation: 67 were diagnosed with adenomyosis (main group) and 30 were healthy women (control group). The stage of adenomyosis was assessed according to the criteria described by M. Squatrito et al. Hormonal studies included determination of follicle-stimulating hormone, luteinizing hormone, sex hormone-binding globulin, progesterone, estradiol, prolactin, cortisol, testosterone, androstenedione, dehydroepiandrosterone, anti-Müllerian hormone, leptin in the follicular and luteal phases of the menstrual cycle. To monitor the quality of life of patients, pain was assessed using a visual analog scale. Statistical processing of the obtained data was carried out using the standard StatSoft Statistica for Windows 13.0 software package. Results. In the follicular phase of the menstrual cycle, all hormones of the pituitary-ovarian axis underwent changes whose depth correlated with the severity of the disease (p < 0.05). The content of estrogens is constantly increasing in the blood serum of women with adenomyosis compared to the control group (p < 0.0001), with especially noticeable increase not only in the content of estradiol, which is physiological under these conditions, but also estrone. A decrease in progesterone and androgen levels was found, which deepened with increasing stage of the disease. The content of stress hormones was highest in the second phase of the menstrual cycle and correlated with pain syndrome (r = 0.91; p < 0.01). The study revealed an increase in leptin levels in women of the main group compared to the control one, which begins with stage II (p < 0.0001), progressively increases with the severity of adenomyosis, exceeding the reference norms by more than 3 times in stage III of the disease (p < 0.0001) that indicates the involvement of metabolic processes in the pathogenesis. Conclusions. The role of changes in metabolism and sex hormones, neuroendocrine disorders of the hypothalamic-pituitary-ovarian axis in the pathogenesis of adenomyosis is undoubted. The most pronounced are changes in the estrogen-gestagen system whose severity correlates with the stage of the disease. All patients with stage III adenomyosis have an increase in the content of stress hormones, which correlates with the severity of the pain syndrome (r = –0.82; p < 0.05). Testosterone levels in adenomyosis are reduced and correlate with cortisol levels (r = –0.67; p < 0.05). The detected increase in leptin levels in women with adenomyosis compared to healthy women (p < 0.0001) occurs with an increase in disease severity and allows us to consider adenomyosis as a multisystem disease.
аденоміоз; фолікулостимулюючий гормон; лютеїнізуючий гормон; пролактин; тестостерон; кортизол; лептин
adenomyosis; follicle-stimulating hormone; luteinizing hormone; prolactin; testosterone; cortisol; leptin
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Pados G, Gordts S, Sorrentino F, Nisolle M, Nappi L, Daniilidis A. Adenomyosis and Infertility: A Literature Review. Medicina (Kaunas). 2023;59(9):1551. doi: 10.3390/medicina59091551.
- Semenyna HB, Korytko OO. Effectiveness of vitex agnus castus extract in the treatment of primary dysmenorrhea. Mìžnarodnij endokrinologìčnij žurnal. 2022;18(1):17-21. doi: 10.22141/2224-0721.18.1.2022.1141.
- Fartushok TV, Semenyna HB, Yurchyschyn OM, Komissarova OV. Ways to improve natural fertility. Wiad Lek. 2021;74(1):144-149. doi: 10.36740/Wlek202101128.
- Semenyna HB, Hrytsko MI, Doroshenko-Kravchyk MV, Korytko OO, Fartushok TV. New opportunities for correction of hormonal disorders and oxidative stress in women with genital endometriosis. Mìžnarodnij endokrinologìčnij žurnal. 2024;20(1):41-47. Ukrainian. doi: 10.22141/2224-0721.20.1.2024.1356.
- Donnez J, Stratopoulou CA, Dolmans MM. Endometriosis and adenomyosis: Similarities and differences. Best Pract Res Clin Obstet Gynaecol. 2024;92:102432. doi: 10.1016/j.bpobgyn.2023.102432.
- Shafrir AL, Mu F, Elissen AH, et al. Endogenous steroid hormone concentrations and risk of endometriosis in nurses’health study II. Am J Epidemiol.2022;192(4):573-586. doi: 10.1093/aje/kwac219.
- Dinsdale N, Nepomnaschy P, Crespi B. The evolutionary bio–logy of endometriosis. Evol Med Public Health. 2021;9(1):174-191. doi: 10.1093/emph/eoab008.
- Becker CM, Bokor A, Heikinheimo O, et al.; ESHRE Endometriosis Guideline Group. ESHRE guideline: endometriosis. Hum Reprod Open. 2022;2:hoac009. doi: 10.1093/hropen/hoac009.
- Squtrito M, Vervier J, Bindels J, et al. Impaired fertility in adenomyosis: a murine model reveals endometrial receptivity and progesterone resistance imbalances. Reproduction. 2024;167(5):e240019. doi: 10.1530/REP-24-0019.
- Droz J, Howard FM. Use of the Short-Form McGill Pain Questionnaire as a diagnostic tool in women with chronic pelvic pain. J Minim Invasive Gynecol. 2011;18(2):211-217. doi: 10.1016/j.jmig.2010.12.009.
- Bulun SE, Yildiz S, Adli M, et al. Endometriosis and adenomyosis: shared pathophysiology. Fertil Steril. 2023;119(5):746-750. doi: 10.1016/j.fertnstert.2023.03.006.
- Leyendecker G, Kunz G, Noe M, Herbertz M, Mall G. Endometriosis: a dysfunction and disease of the archimetra. Hum Reprod Update. 2018;4(5):752-762. doi: 10.1093/humupd/4.5.752.
- Bonavina G, Taylor HS. Endometriosis-associated infertility: From pathophysiology to tailored treatment. Front Endocrinol (Lau–sanne). 2022;13:1020827. doi: 10.3389/fendo.2022.1020827.
- Horne AW, Missmer SA. Pathophysiology, diagnosis, and management of endometriosis. BMJ. 2022;379:e070750. doi: 10.1136/bmj-2022-070750.
- Schrager S, Yogendran L, Marquez CM, Sadowski EA. Adenomyosis: Diagnosis and Management. Am Fam Physician. 2022;105(1):33-38.
- Maia H Jr, Haddad C, Coelho G, Casoy J. Role of inflammation and aromatase expression in the eutopic endometrium and its relationship with the development of endometriosis. Womens Health (Lond). 2012;8(6):647-658. doi: 10.2217/whe.12.52.
- Subbaramaiah K, Iyengar NM, Morrow M, Elemento O, Zhou XK, Dannenberg AJ. Prostaglandin E2 down-regulates sirtuin 1 (SIRT1), leading to elevated levels of aromatase, providing insights into the obesity-breast cancer connection. J Biol Chem. 2019;294(1):361-371. doi: 10.1074/jbc.RA118.005866.
- Khan KN, Fujishita A, Mori T. Pathogenesis of Human Adenomyosis: Current Understanding and Its Association with Infertility. J Clin Med. 2022;11(14):4057. doi: 10.3390/jcm11144057.
- Jiang W, Dai Z, Chen G. Estrogen Sulfotransferase Induction Inhibits Breast Cancer Cell Line MCF-7 Proliferation. Biomed J Sci Tech Res. 2019;22(5):16960-16967. doi: 10.26717/bjstr.2019.22.003812.
- Absenger Y, Hess-Stumpp H, Kreft B, et al. Cyr61, a deregulated gene in endometriosis. Mol Hum Reprod. 2024;10(6):399-407. doi: 10.1093/molehr/gah053.
- Chen P, Mamillapalli R, Habata S, Taylor HS. Endometriosis Cell Proliferation Induced by Bone Marrow Mesenchymal Stem Cells. Reprod Sci. 2021;28(2):426-434. doi: 10.1007/s43032-020-00294-4.
- Emond JP, Caron P, Pušić M, et al. Circulating estradiol and its biologically active metabolites in endometriosis and in relation to pain symptoms. Front Endocrinol (Lausanne). 2023;13:1034614. doi: 10.3389/fendo.2022.1034614.
- Alborzi S, Askary E, Khorami F, et al. A Detailed Study in Adenomyosis and Endometriosis: Evaluation of the Rate of Coexistence Between Uterine Adenomyosis and DIE According to Imaging and Histopathology Findings. Reprod Sci. 2021;28(8):2387-2397. doi: 10.1007/s43032-021-00527-0.
- Lv M, Yu J, Huang Y, et al. Androgen Signaling in Ute–rine Diseases: New Insights and New Targets. Biomolecules. 2022;12(11):1624. doi: 10.3390/biom12111624.
- Maclean A, Tipple L, Newton E, Hapangama DK. Hormone receptor profile of ectopic and eutopic endometrium in adenomyosis: a systematic review. Hum Repr Open. 2025;1:hoaf002. doi: 10.1093/hropen/hoaf002.
- Mori T, Nagasawa H. Mechanisms of development of prolactin-induced adenomyosis in mice. Acta Anat (Basel). 1983;116(1):46-54. doi: 10.1159/000145724.
- Mirabi P, Alamolhoda SH, Golsorkhtabaramiri M, Namdari M, Esmaeilzadeh S. Prolactin concentration in various stages of endometriosis in infertile women. JBRA Assist Reprod. 2019;23(3):225-229. doi: 10.5935/1518-0557.20190020.
- Kutlesic R, Kutlesic M, Milosevic-Stevanovic J, Vukomanovic P, Stefanovic M, Mostic-Stanisic D. Prolactin and Hyperprolactinaemia in Endometriosis-Related Infertility: Are There Clinically Significant Connections? J Clin Med. 2024;13(19):5868. doi: 10.3390/jcm13195868.
- Ranjan M, Lee O, Cottone G, et al. Progesterone receptor antagonists reverse stem cell expansion and the paracrine effectors of progesterone action in te mouse mammary gland. Breast Cancer Res. 2021;23(1):78. doi: 10.1186/s13058-021-01455-2.
- Grimm SL, Hartig SM, Edwards DP. Progesterone Receptor Signaling Mechanisms. J Mol Biol. 2016;428(19):3831-3849. doi: 10.1016/j.jmb.2016.06.020.
- Pankiv V, Yuzvenko T, Kobyliak N, Pankiv I. Correction of Androgen Deficiency in Men with Type 2 Diabetes. Rev Recent Clin Trials. 2022;17(1):34-39. doi: 10.2174/1574887116666211202155304.
- Kamal AM, Bulmer JN, DeCruze SB, Stringfellow HF, Martin-Hirsch P, Hapangama DK. Androgen receptors are acquired by healthy postmenopausal endometrial epithelium and their subsequent loss in endometrial cancer is associated with poor survival. Br J Cancer. 2016;114(6):688-696. doi: 10.1038/bjc.2016.16.
- Maclean A, Bunni E, Makrydima S, et al. Fallopian tube epithelial cells express androgen receptor and have a distinct hormonal responsiveness when compared with endometrial epithelium. Hum Reprod. 2020;35(9):2097-2106. doi: 10.1093/humrep/deaa177.
- Kim TH, Bae N, Kim T, et al. Leptin Stimulates Endometrio–sis Development in Mouse Models. Biomedicines. 2022;10(9):2160. doi: 10.3390/biomedicines10092160.
- Roubos EW, Dahmen M, Kozicz T, Xu L. Leptin and the hypothalamo-pituitary-adrenal stress axis. Gen Comp Endocrinol. 2012;177(1):28-36. doi: 10.1016/j.ygcen.2012.01.009.